黑色非金属单质化学式_黑色非金属单质
1.色金属单质和非金属单质有哪些
2.中学化学非金属单质有哪些
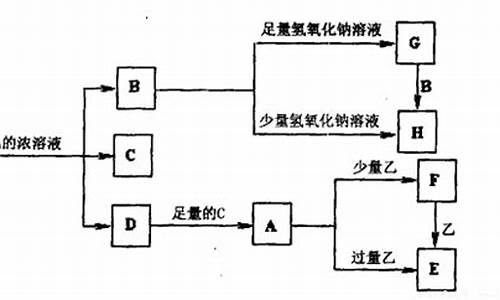
3.A、X、6、七是中学常见的单质和化合物.它们在一定条件下能发生如下转化,转化中的部分产物已省略.(二
无机推断题常见突破点归纳
1. 特殊颜色
(1)火焰颜色
苍白色:H2在Cl2中燃烧
蓝色:CO在空气中燃烧
淡蓝色:H2S、CH4、H2在空气中燃烧
焰色反应:Na+(**)、K+(紫色)
(2)有色溶液
Fe2+:浅绿色
Fe3+:**
Cu2+:蓝色
MnO4-:紫红色
(3)有色固体
红色:Cu、Cu2O、Fe2O3
红褐色:Fe(OH)3
绿色:Cu2(OH)2CO3、FeSO4.7H2O
蓝色:Cu(OH)2、CuSO4.5H2O
黑色:CuO、FeO、FeS、CuS、MnO2、PbS、炭黑
浅**:S、Na2O2、AgBr
**:AgI、Ag3PO4
白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3
有色气体:
黄绿色:Cl2
红棕色:NO2
1)溶于水显碱性的气体只有NH3
(2)在空气中迅速由无色变为红棕色的气体只有NO
(3)能与SO2等气体或其水溶液作用析出浅**固体的只有H2S(包括与Cl2、O2、NO2等氧化性较强的气体作用均有此现象)。
(4)在一定条件下能漂白有色物质的淡**固体只有Na2O2
(5)在空气中能自燃的固体物质只有白磷
(6)遇SCN-显红色的只有Fe3+
(7)常见的可溶于NaOH溶液的白色沉淀有Al(OH)3和Zn(OH)2,可溶于NaOH溶液的金属氧化物有Al2O3和ZnO。
(8)可溶于氢氟酸的酸性氧化物只有SiO2
(9)能与盐酸作用产生无色无味的气体,且通入澄清石灰水中能产生白色沉淀的,只有含(CO3)2-或(HCO3)2-的物质。
(10)能与盐酸作用产生有刺激性气味的无色气体,且通入品红溶液中能使之褪色,加热又复原的只有含(SO3)2-或(HSO3)2-的物质。
(11)能与浓H2SO4、铜片共热产生红棕色气体的晶体只有硝酸盐。
(12)通入CO2能产生白色胶状沉淀且不溶于任何酸的溶液中一定含有(SiO3)2-。
(13)需要控制在170℃才能生成的气体只有C2H4。
(14)能与新制悬浊液混Cu(OH)2合加热生成砖红色沉淀的酸性物质只有甲酸。
(15)不溶于水又不溶于稀盐酸或稀硝酸的化合物有:BaSO4(白色)、AgCl(白色)、CuS(黑色)、PbS(黑色)等。
(16)有消毒、杀菌和漂白作用的物质有:HClO、H2O2、Na2O2、O3和SO2等。
3. 特征反应
(1)能与强酸反应产生气体的物质:
活泼的金属:Na、Al、Zn等;不稳定的弱酸盐:碳酸盐、碳酸氢盐、硫化物、亚硫酸盐等。
(2)能与强碱或其溶液反应产生气体的物质:
单质:Al、Si;盐类:铵盐、羧酸盐(与碱石灰共热)等。
(3)既能与强酸又能与强碱溶液反应的物质:
金属单质:Al、Zn等;氧化物:Al2O3、ZnO等;氢氧化物:Al(OH)3、Zn(OH)2等;弱酸的铵盐:NH4HCO3、(NH4)2CO3、(NH4)2S、(NH4)2SO3等;弱酸的酸式盐:NaHCO3、NaHS、NaHSO3等;氨基酸。
(4)能与水反应产生气体的物质:
活泼的金属单质:Na、K、Mg(加热)、Fe(高温生成Fe3O4)等;非金属单质:F2;金属过氧化物:Na2O2等;金属碳化物:CaC2等;金属氮化物:Mg3N2等。
色金属单质和非金属单质有哪些
黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O4
高中化学常见物质的颜色和状态
1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O4
2、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷 3、淡**固体 :S、 Na2O2、 AgBr
4.紫黑色固体:KMnO4、I2 5、**固体: AgI 、Ag3PO4
6、绿色固体: Cu2(OH)2CO3 7、蓝色晶体:CuSO4·5H2O
8 、蓝色沉淀 Cu(OH)2 9、红褐色沉淀: Fe(OH)3
10、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)
11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕**,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀: BaSO4 、AgCl
13、不溶于水的白色沉淀 CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、 Mg(OH)2 等
14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)
(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)
(3) 红棕色气体: Br2(气体) NO2
(4)黄绿色气体:Cl2
(5)臭鸡蛋气味气体:H2S
15、 具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精
16、有毒的: 气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)
中学常见物质颜色归纳
1. 单质
化学式 颜色 化学式 颜色 化学式 颜色
Cu 紫红 Au 黄 S 黄
B 黄或黑 F2 淡黄绿 C(石墨) 黑
Cl2 黄 Br2 红棕 C(金刚石) 无
Si 灰黑 I2 紫黑 P 白、黄、红棕
2.氧化物
化学式 颜色 化学式 颜色 化学式 颜色
NO2 棕红 ClO2 黄 Na2O2 浅黄
K2O 黄 Pb3O4 红 MnO 绿
化学式 颜色 化学式 颜色 化学式 颜色
CuO 黑 MnO2 黑 Ag2O 棕黑
FeO 黑 ZnO 白 Fe3O4 黑
Hg2O 黑 Fe2O3 红棕 HgO 红或黄
Cu2O 红
3.氧化物的水化物
化学式 颜色 化学式 颜色 化学式 颜色
Fe(OH)3 红褐 HNO2溶液 亮蓝 CU(OH)2 蓝
4.盐
化学式 颜色 化学式 颜色 化学式 颜色
CuFeS2 黄 ZnS 白 Ag2S 黑
FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红
HgS 红 PbS 黑 CuS 黑
Cu2S 黑 FeCl3·6H2O 棕黄 FeSO4 9H20 蓝绿
Fe2(SO4)3 9H2O 棕黄 Fe3C 灰 FeCO3 灰
Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄
AgF 黄 CuCl2 7H2O 蓝绿 AgCl 白
CuSO4 白 AgBr 浅黄 CuSO4 5H2O 蓝
AgI 黄 Cu2(OH2)CO3 暗绿
5.盐溶液中离子特色:
化学式 颜色 化学式 颜色 化学式 颜色
Cu2+ 蓝 MnO4- 紫红 [CuCl4]2- 黄
Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄
6.非金属互化物
物质 颜色 物质 颜色 物质 颜色
氯水 黄绿 溴水 黄-橙 碘水 黄褐
溴的有机溶液 橙红-红棕 I2的有机溶液 紫红
7.其它:蛋白质遇浓 变黄、 遇淀粉变蓝、 TNT 淡黄 、 遇酚酞溶液变紫
中学化学非金属单质有哪些
色金属单质:主族的 基本都是银白色 不少金属 粉末状是黑色 铁粉 银粉等 铜是红色 金是** 你问的是单质 化合物颜色比较丰富
非金属元素是元素的一大类,在所有的一百多种化学元素中,非金属占了22种.在周期表中,除氢以外,其它非金属元素都排在表的右侧和上侧,属于p区.包括氢、硼、碳、氮、氧、氟、硅、磷、硫、氯、砷、硒、溴、碲、碘、砹、氦、氖、氩、氪、氙、氡.
A、X、6、七是中学常见的单质和化合物.它们在一定条件下能发生如下转化,转化中的部分产物已省略.(二
Cl、H、O、S、N、P、C、Si
非金属单质:气态的都是含“气”字旁的,其他固态含“石”字旁。颜色那就靠自己积累了,eg:cl2黄绿色,S**,C黑色,这就不能具体了。
(3)A为氧化性3单质,Z为淡**固体,Z应为Na2O2,X为Na,A为O2,Y为Na2O,Na2O2由钠离子与过氧根离子构成,阴阳离子个数3最简比是3:2,过氧化钠投入到含有少量酚酞3水溶液中,反应生成氢氧化钠与氧气,溶液呈碱性,故溶液变红,由于过氧化钠有强氧化性,使红色又褪去,故现象为:有气泡产生,溶液先变红后再褪色,
故答案为:3:2;有气泡产生,溶液先变红后再褪色;
(2)A既是氧化物又是氢化物,应为H2O,X为黑色非金属单质,则X为C,碳与水蒸气反应生成Y为CO,反应方程式为:C+H2O(g)
| ||
| ? |
故答案为:C+H2O(g)
| ||
| ? |
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。