某金属单质_某金属单质具有体心立方结构原子量
1.某课外小组对一些金属单质和化合物的性质进行研究.(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
2.某课外小组对一些金属单质和化合物的性质进行探究。(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
3.金属单质与盐反应
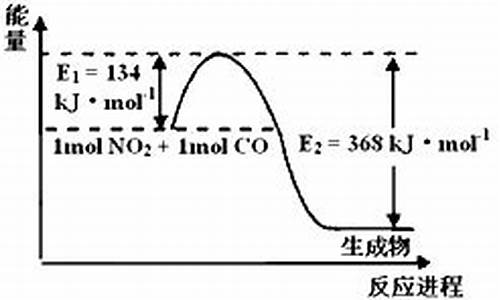
某银白色金属单质A在空气中加热燃烧时发出**火焰,说明含有钠元素,A在空气中燃烧得到淡**固体B,则A是Na,B是Na2O2,钠露置在空气中足够长时间变为Na2CO3,所以C是Na2CO3,过氧化钠和酸性气体反应生成Na2CO3,则D是CO2.
(1)①钠密度小于水,所以钠浮在水面上;
②钠的熔点低,钠和水反应放热,所以钠熔成闪亮的小球;
③钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声,所以小球在水面上四处游动,并发出咝咝声;
④反应后溶液生成氢氧化钠,方程式:2Na+2H2O=2NaOH+H2↑,溶液呈碱性,遇到酚酞溶液变红;
故答案为:
| 现象 | 分析(原因) |
| 钠浮在水面上 | 钠密度小于水 |
| 钠熔成闪亮的小球 | 钠的熔点低,钠和水反应放热 |
| 小球在水面上四处游动,并发出咝咝声 | 钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声 |
| 溶液变红色 | 反应后溶液生成氢氧化钠,溶液呈碱性,酚酞试液遇碱变红色 |
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Cl2+2NaOH=NaCl+NaClO+H2O.
某课外小组对一些金属单质和化合物的性质进行研究.(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
金属单质4.8g在氧气中充分燃烧,可生成8g的氧化物,说明金属与氧的质量比为4.8:3.2=3:2,又因为金属是二价的,所以金属与氧的物质的量之比为1:1,所以该金属的相对原子质量是氧的3/2倍,即24(就是Mg嘛……)
某课外小组对一些金属单质和化合物的性质进行探究。(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
(1)将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,反应为2Al+3CuCl2=3Cu+2AlCl3,
离子方程式为:2Al+3Cu2+═2Al3++3Cu 红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为2Cu+O2+CO2+H2O=Cu2(OH)2CO3,
故答案为:2Al+3Cu2+═2Al3++3Cu;2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(2)实验分离出的溶液是氯化铝溶液,惰性电极电解阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,附近氢氧根离子和铝离子反应生成氢氧化铝沉淀,随氢氧根离子浓度增大,氢氧化铝可以溶解于碱中,反应的离子方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:有白色沉淀生成,后沉淀逐渐溶解至消失;Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(3)①高温时,铝与二氧化锰发生置换反应生成锰,反应的方程式为3MnO2+4Al
| ||
| ? |
| ||
| ? |
②根据氧化还原反应可知Mn由+4价变为+2价,氧化合价肯定升高,所以产物有氧气生成,反应为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
金属单质与盐反应
| (1)2Al+6H + =2Al 3 + +3H 2 ↑或2Al+3Cu 2 + =2Al 3 + +3Cu 2Cu+O 2 +H 2 O+CO 2 =Cu 2 (OH) 2 CO 3 (2)有白色沉淀生成,后沉淀逐渐溶解至消失 Al 3 + +3OH - =Al(OH) 3 ↓,Al(OH) 3 +OH - =AlO 2 - +2H 2 O (3)①3MnO 2 +4Al 3Mn+2Al 2 O 3②MnO 2 +H 2 O 2 +2H + =Mn 2 + +O 2 ↑+2H 2 O |
| (1)由CuCl 2 溶液中Cu 2 + 的水解使溶液呈酸性,所以会有2Al+6H + =2Al 3 + +3H 2 ↑,也有2Al+3Cu 2 + =2Al 3 + +3Cu;单质铜在潮湿空气中由红色变为绿色,化学方程式可写出2Cu+O 2 +H 2 O+CO 2 =Cu 2 (OH) 2 CO 3 。 (2)用石墨作电极,电解AlCl 3 溶液,电解的化学方程式为:2AlCl 3 +6H 2 O 2Al(OH) 3 ↓+3H 2 ↑+3Cl 2 ↑。 持续电解,电解水,阴极:2H 2 O+2e - =H 2 ↑+2OH - 从而使阴极区OH - 浓度增大,所以会看到有白色沉淀生成,后沉淀逐渐溶解至消失。 (3)①类似于铝热反应。②根据题意可写出离子方程式:MnO 2 +H 2 O 2 +2H + =Mn 2 + +O 2 ↑+2H 2 O。 |
金属单质与盐反应是一种常见的化学反应类型,这种反应通常涉及到了氧化还原反应。
扩展知识:
金属单质与盐反应需要一定的条件才能发生。首先,必须满足金属单质的活性要大于与它发生反应的金属离子的活性。其次,需要确保金属单质在溶液中不会发生氧化或水解等副反应。此外,温度和压力也会影响这种反应的进行。
金属单质与盐反应的原理主要是置换反应。在这种反应中,金属单质(通常是较活泼的金属)可以与另一种金属化合物(通常是盐)反应,生成另一种金属单质和另一种盐。这种反应的本质是金属原子与金属离子之间的电子交换。
金属单质与盐反应在工业上和实验室中都有广泛的应用。例如,可以利用这种反应制备某些不易获得的金属单质,也可以利用这种反应进行某些元素的分离和提纯。在实验室中,可以通过观察这种反应来研究金属的化学性质和化学反应动力学。
以铁和硫酸铜的反应为例,铁是一种比较活泼的金属,硫酸铜是一种盐,当它们混合在一起时,会发生置换反应,生成铜和硫酸亚铁。具体反应方程式为Fe+CuSO4=Cu+FeSO4。在这个过程中,铁原子从硫酸铜分子中夺取了铜原子,自身被氧化成了二价铁离子,而铜离子则被还原成了铜原子。
金属单质与盐反应需要注意一些问题。首先,要确保使用的金属单质和盐都是纯净的,以避免杂质对反应的影响。其次,要控制好反应条件,例如温度、压力、溶液的pH值等,这些因素都会影响反应的速率和产物的性质。此外,还需要注意操作安全,避免金属单质和盐对环境和人体的危害。
综上所述,金属单质与盐反应是化学中常见的反应之一,这种反应涉及到置换反应和氧化还原反应两个基本概念。在实践中,需要掌握好反应原理、条件及应用范围,同时注意实验安全,确保得到良好的实验结果。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












