某实验小组在探究金属的化学性质时_某同学探究金属单质
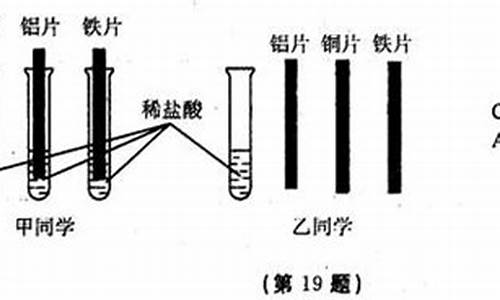
1.某校甲乙两个兴趣小组为探究锌铜银三种金属的化学活动性顺序,家族同学选用了三种物质,是哪三种?
2.某兴趣小组对物质的性质和成分进行相关探究.(1)常见金属活动性顺序如下,填写相应的元素符号:某同学
3.金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B 加热 . A2B.某校一课外小组的甲、乙、
4.(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。Ⅰ.(1)试用实验室提供的下列试
5.某校化学研究学习小组的同学在一次活动中查阅资料时发现,单质碳能够在高温时与金属氧化物反应得到金属单
6.在实验室中,小明同学为了探究金属与盐溶液的反应规律,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3
首先根据X、Y、Z是三种不同的金属,其中Y可以和盐酸反应,说明Y金属活动性位于氢前,活动性强于X和Z;然后根据X能置换出Z的化合物中的Z,说明,X的金属活动性强于Z;故Y>H>X>Z.
故选C.
某校甲乙两个兴趣小组为探究锌铜银三种金属的化学活动性顺序,家族同学选用了三种物质,是哪三种?
探究活动1:电池表皮为锌,碳棒上有铜帽,里面含有黑色物质二氧化锰,所以本题答案为:锌,碳,MnO2;
设计方案2:酚酞遇碱变红,碱液中含有氢氧根离子,碳酸根离子遇酸化气,硫酸根离子能与钡离子结合生成白色沉淀,而加入氯化钡能引入氯离子,干扰氯离子的检验,所以应该加入硝酸钡,氯离子能与银离子结合生成白色不溶于稀硝酸的沉淀,碘遇淀粉变蓝,所以本题答案为:
| 操作步骤 | 实验现象 | 相应的结论 |
| ? | ? | OH- |
| ? | ? | CO32- |
| Ba(NO3)2 | 无白色沉淀 | ? |
| ? | ? | Cl- |
| ? | ? | 淀粉 |
某兴趣小组对物质的性质和成分进行相关探究.(1)常见金属活动性顺序如下,填写相应的元素符号:某同学
解:在欲探究的三种金属锌、铜、银活动性为锌>铜>银.所以我们在实验设计时可以设计的最简单的就是三种药品的方法:①取中间的金属对应的可溶性的盐溶液,其余两种都用单质,本题就是Zn、CuSO4溶液(其他可溶性铜盐也可以)、Ag.具体操作是取两只试管,分别加入Zn和Ag单质后滴加几滴铜的盐溶液,观察实验现象.锌的表面变红,得出:Zn>Cu;而Ag的表面无明显现象,得出Cu>Ag.所以Zn>Cu>Ag.②取中间的金属的单质,另外两种取对应盐溶液.本题就是锌盐、铜片、银盐.具体操作:将锌盐和银盐分别滴加到打磨后的铜片上(分开),观察实验现象.滴加锌盐处颜色无明显变化,说明Zn>Cu;滴加银盐处变成白色,说明Cu>Ag.在上面的两类方案中,②在操作起来更方便快捷,现象对比更明显.
金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B 加热 . A2B.某校一课外小组的甲、乙、
(1)由金属的活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au可知,在金属活动顺序表空格内应填入Mg、Ag;铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
(2)实验与讨论除去气体样品中的二氧化碳,应将气体通入到氢氧化钠溶液中,由于一氧化碳的密度小于水的密度,可通过右边长导管将氢氧化钠排出,将气体收集在集气瓶中,所以,最为合理装置是c;
实验求证为了验证生成的气体中是否含有一氧化碳,A中应加入的固体是氧化铜,实验的现象是B中澄清石灰水浑浊,可说明气体样品中含有一氧化碳等.
实验反思由于在一氧化碳、二氧化碳中,碳、氧元素的质量别是3:4、3:8,所以,炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比大于3:8.
故答案为:(1)Mg、Ag,Fe+CuSO4=Cu+FeSO4,置换反应;
(2)实验与讨论c;实验求证氧化铜、变浑浊;实验反思大于.
(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。Ⅰ.(1)试用实验室提供的下列试
对比甲、乙两同学所用A和B的质量及生成A2B的质量:同样生成5.0gA2B,甲实验B的用量为1.0g、乙实验B的用量为4.0g,则可得反应生成5.0gA2B时需要消耗B的质量为1.0g;利用质量守恒定律,可判断生成5.0gA2B时消耗B的质量为1.0g,则消耗A的质量=5.0g-1.0g=4.0g,则两物质恰好完全反应时,A、B两物质的用量比为4:1;
根据反应中反应物A、B两物质的质量比为4:1及质量守恒定律,由于丙同学实验中生成A2B的质量3.0g,若A的用量=3.0g×
| 4 |
| 5 |
| 1 |
| 5 |
故答案为:3:7或37:3.
某校化学研究学习小组的同学在一次活动中查阅资料时发现,单质碳能够在高温时与金属氧化物反应得到金属单
| Ⅰ(1)方案一:用形状大小相同的铝条和镁条分别一等体积等浓度的稀盐酸反应,观察其反应速率快慢?(2分) 方案二:分别向等体积等浓度的氯化铝溶液、氯化镁溶液中加入氢氧化钠溶液至过量,观察其沉淀及其溶解情况(2分) Ⅱ(1)分液漏斗;防倒吸(每空1分) (2)硫化钠溶液(1分)有**沉淀生成(1分) S 2 - +Cl 2 =2Cl - +S↓(2分) 氢氧化钠溶液(1分) (3)利用非金属元素最高价氧化物对应水化物酸性强弱来比较元素非金属性强弱 (2分)?硝酸有挥发性,随二氧化碳一起逸出(2分) |
| 试题分析:Ⅰ(1)方案一:判断金属性强弱可以依据金属与酸反应的剧烈程度,因此可以设计金属与相同浓度的盐酸生成气体的剧烈程度判断镁和铝金属性强弱; 方案二:根据氢氧化镁、氢氧化铝是否溶于强碱设计,过量碱液可使生成的Al(OH) 3 溶解,而Mg(OH) 2 则不溶,具体方法:分别向等体积等浓度的氯化铝溶液、氯化镁溶液中加入氢氧化钠溶液至过量,观察其沉淀及其溶解情况; Ⅱ(1)根据仪器结构特点可知A为分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中; (2)若要证明非金属性:Cl>S,可以利用单质之间的置换反应。B中产生氯气,则在C中加入硫化钠溶液,;氯气与硫化钠分子置换反应生成氯化钠和单质硫,所以观察到C中溶液有**沉淀生成的现象,即可证明,反应的离子方程式为S 2 - +Cl 2 =2Cl - +S↓;氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气; (5)要证明非金属性是N>C,则可以利用最高价氧化物水化物的酸性强弱来比较,依据较强的酸可以制备较弱的酸可知,如果在A中加稀硝酸,B中加碳酸钙,则B中产生CO 2 ,CO 2 能使澄清石灰水变浑浊,因此C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。由于硝酸有挥发性,随二氧化碳一起逸出进入澄清的石灰水,因此没观察到上述现像。 |
在实验室中,小明同学为了探究金属与盐溶液的反应规律,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3
| 实验准备(2)CO 2 +Ca(OH) 2 = CaCO 3 ↓+H 2 O 实验结论 铜?一氧化碳溶液变浑浊(或出现白色沉淀) 反思评价(1)水蒸气冷凝而倒流,造成热的试管炸裂 (2)不能?二氧化碳不能燃烧,使混合气体不能点燃 |
| 试题分析:(2)二氧化碳能使澄清的石灰水变浑浊。可利用二氧化碳的这一性质检验其存在。反应的化学方程式为:CO 2 +Ca(OH) 2 = CaCO 3 ↓+H 2 O 实验与结论A中固体由黑色变成红色,说明有黑色的氧化铜与木炭反应生成了红色的铜 B中**试纸没有变蓝说明没有一氧化碳生成 反应中有CO 2 生成由会使C中的澄清石灰水变浑浊 反思与评价 (1) 如果A装置中的试管口高于试管底部,在实验过程中可能会因水的倒流而造成试管的炸裂。 (2)设产生的气体是CO和CO 2 的混合气体,则不能直接用点燃的方法来检验CO 2 。因为二氧化碳不能燃烧,使混合气体不能点燃。 |
由题意可知,溶液显蓝色,说明了溶液中存在着铜离子;由滤渣中加入稀盐酸无气体产生,说明在滤渣不存在着活泼金属;由向溶液中滴加稀盐酸无沉淀生成,可以判断滤液的银离子已被完全置换出来.由此可知:
A、由于向溶液中滴加稀盐酸无沉淀生成,说明了滤液中一定没有银离子.故A正确;
B、若加入的金属M是铜,则滤渣中只含有银.故B正确;
C、若加入的金属M是铜,恰好与硝酸银反应,则滤渣中一定不含有单质铜.故C错误;
D、由于锌的活泼性大于铜和银,生成的硝酸锌是无色,所以,加入的金属M可能是单质锌.故D正确.
故选C.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












