金属单质和非金属单质的区别_金属单质和非金属单质
1.1.金属单质和非金属单质 2. 金属和金属 3.非金属和金属 发生置换反应的化学反应方程式
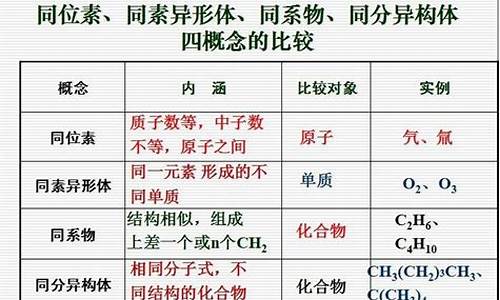
2.单质分为哪三大类?
1、书写化学式时,金属?单质?和非金属?单质?没有固定的先后顺序。
2、但在书写由金属元素和非金属元素组成的?化合物的化学式?时,一般是金属元素?的符号在前;非金属元素?的符号在后。如:
硫化亚铁 —— FeS ?.
氧化镁 —— MgO ?.
氯化银 —— AgCl ? .
1.金属单质和非金属单质 2. 金属和金属 3.非金属和金属 发生置换反应的化学反应方程式
1.金属单质,非金属单质的通性:
金属元素通常显正价,非金属元素通常显负价,单质元素的化合价为零(实在想不出别的)
2.酸性氧化物的通性:
A.和水反应生成相应的酸
B.和碱反应生成盐(和水)
C.和碱性氧化物反应生成盐(和水)
不过要搞清楚,酸性氧化物并不都是与水化合生成酸的物质。
反例:
SiO2(二氧化硅),根本不能与水反应,但是它是酸性氧化物。
酸性氧化物,又叫酸酐。它和对应的酸的关系是它它们的化合价都是一样的。例如:H2SO4(硫酸)的酸酐就是SO3(三氧化硫)而不是SO2(二氧化硫)。有些非金属氧化物没有对应的酸,所以它就不是酸性氧化物,比如NO(一氧化氮)CO(一氧化碳)。
3.碱性氧化物的通性:
由金属元素和氧元素组成的氧化物是碱性氧化物(铵盐是特例)
A.与酸反应生成盐和水
B.与水反应生成碱
C.与酸性氧化物反应生成盐
D.溶于水生成碱
4.酸的通性:
A.与碱反应生成盐和水
B.与碱性氧化物反应生成盐和水
C.强酸(无氧化性)与金属单质反应生成盐+氢气
强酸(强氧化性)与金属单质反应生成盐+氧化产物
D.与某些盐发生反应
E.有腐蚀性,溶液程酸性.
5.碱的通性:
A.碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色
B.碱能与酸性氧化物反应生成盐和水
C.碱能与酸反应生成盐和水
D.某些碱能与某些盐反应生成新的盐和新的碱
6.盐的通性:
A.某些盐能与较活泼的金属反应生成新的盐和金属
B.某些盐能与酸反应生成新的盐和新的酸
C.某些盐能与某些碱反应生成新的盐和新的碱
D.有些不同的盐之间能反应生成两种新的盐
单质分为哪三大类?
1.金属单质和非金属单质
2Na+2H2O=H2(气体)+2NaOH.
2 金属和金属
Fe+CuSO4=Cu+FeSO4
3.非金属和金属
H2+CuO=加热=Cu+H2O
4,非金属之间
Cl2+2NaBr=2NaCl+Br2
不懂问
单质分为金属单质、非金属单质、稀有气体单质三大类。
单质是由同种元素组成的纯净物。元素以单质形式存在时的状态为元素的游离态。
详情如下:
一般来说,单质的性质与其元素的性质密切相关。如很多金属的金属性都很强,那么它们的单质还原性就很强。不同种类元素的单质,其性质差异在结构上反映得最为突出。与单质相对,由多种元素组成的纯净物是化合物。
非金属单质一般以共价键结合成分子。常温下,很多非金属单质都以双原子分子形式存在,如氢气、氧气等。一些元素还可形成多原子的分子,如臭氧(O3)、足球烯(C60)等。能形成原子晶体的单质在常温下都是固态,而且较硬,如钻石等。
稀有气体的价电子层是满的,所以它们不需要结合成分子以使自己更稳定,因此它们在常温常压下都是单原子分子的气体。上述物质中都没有可自由移动的电子,因此它们都是电的不良导体。例外的是石墨,它具有特殊的层状结构,质地松软,且可以导电。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












