某金属单质具有体心立方结构_某金属单质
1.某课外小组对一些金属单质和化合物的性质进行探究。(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
2.金属单质与非金属单质反应
3.化学元素周期表中哪些金属单质不是碱金属?
解析:
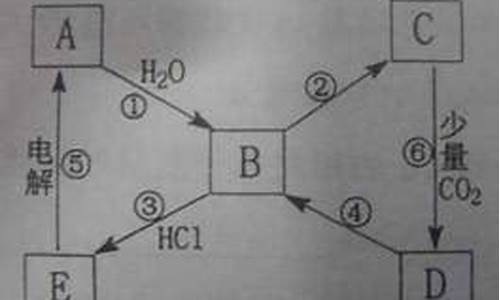
22.
(1)C:Na2CO3、D:CO2、E:NaOH
(2)①2Na + 2H2O ―→ 2NaOH + H2↑
②2Na2O2 + 2CO2 ―→ 2Na2CO3 + O2
③Cl2 + 2NaOH ―→ NaCl + NaClO + H2O
23.设生成的NaOH质量为 x g,O2质量为 y g,则有:
2Na2O2 + 2H2O ―→ 4NaOH + O2↑
78×2 40×4 32
7.8 g x g y g
解得:x = 8 g,y = 1.6 g
所以NaOH物质的量 = 8 g / 40 g/mol = 0.2 mol
标况下O2体积 =( 1.6 g / 32 g/mol)× 22.4 L/mol = 1.12 L
某课外小组对一些金属单质和化合物的性质进行探究。(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
(1)将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,反应为2Al+3CuCl2=3Cu+2AlCl3,
离子方程式为:2Al+3Cu2+═2Al3++3Cu 红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为2Cu+O2+CO2+H2O=Cu2(OH)2CO3,
故答案为:2Al+3Cu2+═2Al3++3Cu;2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(2)实验分离出的溶液是氯化铝溶液,惰性电极电解阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,附近氢氧根离子和铝离子反应生成氢氧化铝沉淀,随氢氧根离子浓度增大,氢氧化铝可以溶解于碱中,反应的离子方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:有白色沉淀生成,后沉淀逐渐溶解至消失;Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(3)①高温时,铝与二氧化锰发生置换反应生成锰,反应的方程式为3MnO2+4Al
| ||
| ? |
| ||
| ? |
②根据氧化还原反应可知Mn由+4价变为+2价,氧化合价肯定升高,所以产物有氧气生成,反应为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
金属单质与非金属单质反应
| (1)2Al+6H + =2Al 3 + +3H 2 ↑或2Al+3Cu 2 + =2Al 3 + +3Cu 2Cu+O 2 +H 2 O+CO 2 =Cu 2 (OH) 2 CO 3 (2)有白色沉淀生成,后沉淀逐渐溶解至消失 Al 3 + +3OH - =Al(OH) 3 ↓,Al(OH) 3 +OH - =AlO 2 - +2H 2 O (3)①3MnO 2 +4Al 3Mn+2Al 2 O 3②MnO 2 +H 2 O 2 +2H + =Mn 2 + +O 2 ↑+2H 2 O |
| (1)由CuCl 2 溶液中Cu 2 + 的水解使溶液呈酸性,所以会有2Al+6H + =2Al 3 + +3H 2 ↑,也有2Al+3Cu 2 + =2Al 3 + +3Cu;单质铜在潮湿空气中由红色变为绿色,化学方程式可写出2Cu+O 2 +H 2 O+CO 2 =Cu 2 (OH) 2 CO 3 。 (2)用石墨作电极,电解AlCl 3 溶液,电解的化学方程式为:2AlCl 3 +6H 2 O 2Al(OH) 3 ↓+3H 2 ↑+3Cl 2 ↑。 持续电解,电解水,阴极:2H 2 O+2e - =H 2 ↑+2OH - 从而使阴极区OH - 浓度增大,所以会看到有白色沉淀生成,后沉淀逐渐溶解至消失。 (3)①类似于铝热反应。②根据题意可写出离子方程式:MnO 2 +H 2 O 2 +2H + =Mn 2 + +O 2 ↑+2H 2 O。 |
化学元素周期表中哪些金属单质不是碱金属?
金属单质与非金属单质之间的反应金属会失去电子,形成阳离子,而非金属会接受电子,形成阴离子。
反应说明:
当金属与非金属发生反应时,通常会产生离子化合物。以钠和氯气的反应为例,钠是一种金属单质,氯是一种非金属单质。钠原子会失去一个电子,形成钠离子(Na+),而氯原子会接受一个电子,形成氯离子(Cl-)。
这两种离子会结合在一起形成氯化钠(NaCl),这是一种常见的离子化合物,也就是我们日常生活中使用的食盐。
共价键的形成:
除了离子化合物的形成,金属单质与非金属单质之间还可以发生共价键的形成。共价键是一种化学键,通过电子的共享来形成。
氧气和氢气的反应就是通过共价键的形成来实现的。氧气是一种非金属单质,氢气也是一种非金属单质。当氧气和氢气反应时,氧原子和氢原子会共享电子,形成水分子(H2O)。在水分子中,氧原子与氢原子通过共价键连接在一起。
金属单质与非金属单质之间的反应的意义:
1.形成新的化合物
金属单质与非金属单质之间的反应通常会形成新的化合物,这些化合物具有不同的性质和用途。这为人们开发新材料和应用提供了广阔的空间。
2.提供新的能源
某些金属单质与非金属单质之间的反应可以释放出大量的能量,如金属与非金属的燃烧反应。这些反应可以用来作为能源,如金属燃料电池的应用。
3.促进科学研究和技术进步
金属单质与非金属单质之间的反应是化学研究和技术发展的重要基础。通过研究这些反应,人们可以深入了解元素之间的相互作用和反应机制,进一步推动科学的发展。
4.扩展应用领域
金属单质与非金属单质之间的反应可以开发出各种具有特殊性质和功能的材料,如合金、陶瓷等。这些材料广泛应用于建筑、电子、航空航天等领域,推动了社会的进步和发展。
5.提供化学反应的多样性
金属单质与非金属单质之间的反应具有多样性,可以发生不同类型的反应,如离子化合物的形成、共价键的形成等。这种多样性丰富了化学反应的研究内容,拓宽了化学反应的应用领域。
1、氢(H)
2、氦(He)
3、锂(Li)
4、铍(Be)
5、硼(B)
6、碳(C)
7、氮(N)
8、氧(O)
9、氟(F)
10、氖(Ne)
11、钠(Na)
12、镁(Mg)
13、铝(Al)
14、硅(Si)
15、磷(P)
16、硫(S)
17、氯(Cl)
18、氩(Ar)
19、钾(K)
20、钙(Ca)
化学元素周期表是根据原子序数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体等。
扩展资料
元素位置推断
1、元素周期数等于核外电子层数;
2、主族元素的序数等于最外层电子数;
3、确定族数应先确定是主族还是副族,其方法是用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
在第一至第五周期时最后的差数小于等于10时差数就是族序数,差为8、9、10时为Ⅷ族,差数大于10时,则再减去10,最后结果为族序数;
在第六、七周期时差数为1:ⅠA族,差数为2:ⅡA族,差数为3~17:镧系或锕系,差数介于18和21之间:减14,差数为22~24:Ⅷ族,差数大于25:减24,为对应的主族
根据各周期所含的元素种类推断,用原子序数减去各周期所含的元素种数,当结果为“0”时,为零族;当为正数时,为周期表中从左向右数的纵行,如为“2”则为周期表中从左向右数的第二纵行,即第ⅡA族;当为负数时其主族序数为8+结果。
百度百科-化学元素周期表
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












