黄绿色的金属_黄绿色非金属单质
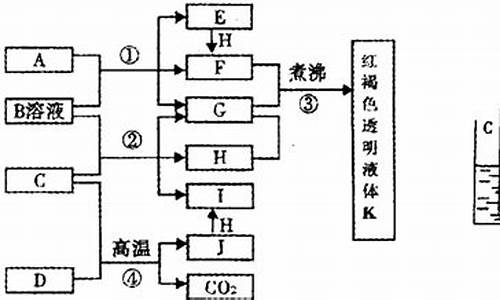
1.已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定
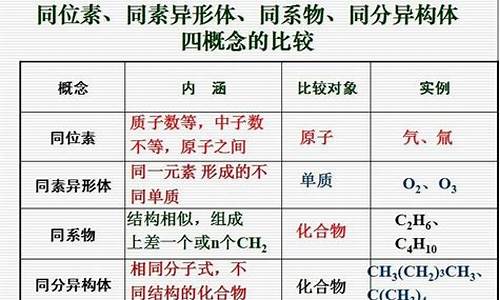
2.对化学物质分类的方法有哪些?
3.氯气有哪些性质?
4.氯的化学性质
(1)由题中信息可知该元素的单质不导电,金属导电;当该元素原子与金属元素原子化合时,只能形成阴离子:该元素原子与非金属元素原子化合时,只显一1价,说明该元素易得到一个电子,显示非金属性,该元素的原子能构成分子,故F元素为非金属元素.
(2)Al原子与F原子化合时Al显+3价.F显-1价,所以这种化合物的化学式为AlF3.
故答案为:(1)该元素的单质不导电,金属导电;当该元素原子与金属元素原子化合时,只能形成F-;该元素原子与非金属元素原子化合时,只显一1价.
(2)AlF3
已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定
红色:Cu;Cu2O;红磷(暗红色)、Fe2O3(棕红色)、Fe(OH)3(红褐色)、[Fe(SCN)]2+(血红)、液Br2(深红棕色)、Br2水(橙色)、Br2(CCl4)红棕色、Br2蒸气(红棕色)、NO2(红棕色)
**:Agl(**)、Ag3PO4(**)、S(淡黄)、Na2O2(淡**)、AgBr(浅黄)、FeCl3(棕黄)、I2水(棕**)、Fe3+(棕**)、Cl2(黄绿色)
蓝色:CuSO4*5H2O、Cu(OH)2、Cu2+的溶液
绿色:FeSO4*7H2O、Fe2+的溶液(淡绿色)、Cl2(黄绿)、F2(淡黄绿)、Cu2(OH)2CO3
黑色:CuO、MnO2、FeS、FeO、Fe3O4、C粉、FeS2、Cu2S、CuS、PbS、Ag2S、Ag2O(棕黑)
紫色:KMnO4溶液(MnO4-紫色)、I2(CCl4)、I2(紫黑色)、[Fe(C6H5O6)]3+(苯酚与氯化铁的生成物)
对化学物质分类的方法有哪些?
| H是黄绿色气体,为Cl 2 ,D是形成化合物种类最多的元素,所以D是碳,D、J元素在周期表中同主族,J是一种金属单质,J元素的+2价化合物比+4价化合物稳定,所以J是Pb,C+D→Pb+CO 2 ,C是金属氧化物,所以C是PbO,PbO+B→Cl 2 +G+I,B与C反应时,每生成1mol?H同时消耗4mol?B和1mol?C,根据得失电子守恒知,B是HCl,A是金属氧化物,A+盐酸→E+F+G,E和氯气反应生成F,所以A中金属元素是变价元素,为铁元素,A是四氧化三铁,E是氯化亚铁,F是氯化铁,G是水,I是PbCl 2 ,氯化铁溶液煮沸得氢氧化铁胶体K. (1)通过以上分析知,A是Fe 3 O 4 ,故答案为:Fe 3 O 4 ; (2)二氧化铅和盐酸反应生成氯化铅、氯气和水,反应方程式为:PbO 2 +4HCl=PbCl 2 +Cl 2 ↑+2H 2 O, 故答案为:PbO 2 +4HCl=PbCl 2 +Cl 2 ↑+2H 2 O (3)铁和铅属于较活泼金属,用热还原法冶炼,故选②; 设转移电子的物质的量是x. 3Fe 3 O 4 +8Al
3mol 24mol 1mol?x x=8mol 故答案为:②;8; (4)用C、J作电极,与硫酸构成的原电池中,铅失电子,二氧化铅得电子,与硫酸反应生成硫酸铅和水,反应方程式为:Pb+PbO 2 +2H 2 SO 4 =2PbSO 4 +2H 2 O, 设消耗硫酸的物质的量是y. Pb+PbO 2 +2H 2 SO 4 =2PbSO 4 +2H 2 O转移电子 2mol 2mol y? 1mol y=1mol,1mol硫酸中氢离子的物质的量是2mol, 故答案为:Pb+PbO 2 +2H 2 SO 4 =2PbSO 4 +2H 2 O;2; (5)向胶体中滴加电解质溶液会产生聚沉现象,氢氧化铁又能和盐酸反应生成可溶性盐,所以沉淀会溶解, 故答案为:开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解. |
氯气有哪些性质?
1、物质分类的方法:?
根据纯净物的颜色、状态、气味、溶解性、可燃性及组成等对物质进行分
类。?
如对下列七种物质:氯化钠、硫酸、氧气、醋酸、氯气、氧化镁、高锰酸
钾,根据分类标准不同可以有不同的分类结果:?
按颜色分类: ?
白色:氯化钠、氧化镁
无色:硫酸、氧气、醋酸
黄绿色:氯气
紫黑色:高锰酸钾
按状态分类
固态:氯化钠、氧化镁、高锰酸钾
液态:硫酸、醋酸
气态:氧气、氯气
按组成分类?
单质:氧气、氯气
化合物:高锰酸钾、氧化镁、氯化钠、硫酸、醋酸
按气味分类
有气味的物质:氯气、醋酸
无气味的物质:氧气、高锰酸钾、氧化镁、氯化钠、硫酸
2、单质和化合物:(1)单质的概念:单质是由同种元素组成的纯净物。
说明:
①单质必须是纯净物,两者是从属关系,即单质概念小,纯净物概念大。
②单质必须是由同一种元素组成。
③一种元素可以组成多种单质,如氧气(O2)和臭氧(O3),两者混在一起不是单质而是混合物,除此之外还有红磷和白磷、金刚石和石墨等。
④单质的分类:
根据单质的性质不同,单质可分为金属单质和非金属单质。
(2)化合物的概念:化合物是由不同种元素组成的纯净物
3、氧化物:(1)概念:由两种元素组成,其中一种是氧元素的化合物称为氧化物。
(2)分类:根据氧化物的组成,除去氧元素,另一种元素是金属元素的氧化物称为金属氧化物,如FeO、CuO等;另一种元素是非金属元素的氧化物称为非金属氧化物,如CO、CO2、SO2、H2O等。?
4、无机化合物和有机化合物:?(1)无机化合物?
无机化合物一般指由碳以外的其他元素组成的化合物,如NaCl、KClO3、H2O等,也包括少数的含碳化合物,如CO、CO2、CaCO3等。
(2)有机化合物 有机化合物主要是指含碳的化合物(碳的氧化物、碳酸、碳酸盐除外),如酒精、蔗糖等。 (3)有机化合物的性质 有机化合物具有相似的性质,如:具有可燃性,完全燃烧时一般生成二氧化碳和水;不完全燃烧时有炭黑小颗粒(黑烟成分)产生。 (4)有机化合物和无机化合物的区别无机物一般能溶于水,溶液能导电,而大多数有机物都难溶于水,熔点低,受热易分解,容易燃烧,不易导电等。
氯的化学性质
氯单质由两个氯原子构成,化学式为Cl2。气态氯单质俗称氯气,液态氯单质俗称液氯。
在常温下,氯气是一种黄绿色、刺激性气味、有毒的气体。压强为1.01×105Pa时,氯单质的沸点为?34.4℃,熔点为?101.5℃。氯气可溶于水和碱性溶液,易溶于二硫化碳和四氯化碳等有机溶剂,饱和时1体积水溶解2体积氯气。
氯气具有强烈的刺激性、窒息气味,可以刺激人体呼吸道黏膜,轻则引起胸部灼热、疼痛和咳嗽,严重者可导致死亡。
[编辑] 化学性质
氯气的化学性质很活泼,它是一种活泼的非金属单质。
氯原子的最外电子层有7个电子,在化学反应中容易结合一个电子,使最外电子层达到8个电子的稳定状态,因此氯气具有强氧化性。
物理属性
熔点 171.6 K(?101.5 °C)
沸点 239.11 K(?34.04 °C)
摩尔体积 17.39 × 10?6 m3/mol
汽化热 10.2 kJ/mol
熔化热 3.203 kJ/mol
蒸气压 1300 帕
声速 无数据
其他性质
电负性 3.16 (鲍林标度)
比热 480 J/(kg·K)
电导率 无数据
热导率 0.0089 W/(m·K)
第一电离能 1251.2 kJ/mol
第二电离能 2298 kJ/mol
第三电离能 3822 kJ/mol
第四电离能 5158.6 kJ/mol
第五电离能 6542 kJ/mol
第六电离能 9362 kJ/mol
第七电离能 11018 kJ/mol
第八电离能 33604 kJ/mol
第九电离能 38600 kJ/mol
第十电离能 43961 kJ/mol
氯原子很容易得到一个电子呈负一价、氯气通常状态下呈黄绿色、有刺激性气体、在低温加压条件下可为液态和固态、是很活泼得非金属单质,有很强得氧化性,能生成金属氯化物、氯气和水反应可生成次氯酸,用于杀菌消毒、也可以制成漂白液
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。