已知a是一种金属单质,b显淡_已知a和e为金属单质
1.A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,
2.已知A~H均为初中化学常见的物质。A为一种金属单质。C与D均为固体.G为红褐色沉淀.H为含两种元素
3.下图中的A→K分别代表初中化学中的常见物质.已知:A、C两物质组成元素相同; G溶液为某物质的稀溶液,G
4.A~E是初中化学常见的物质,已知A和E都可以作燃料,其中A是天然气的主要成分.(1)反应①的化学方程式为
5.A、B、C、D、E、F、H、I、M为初中化学常见的物质,且有如下的转化关系.已知A、B含有相同元素,B、D、H、
6.已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相
7.A~L为中学化学常见的物质,其主要转化关系如图所示(其中产物水已略去).已知A为常见的金属单质,C、D
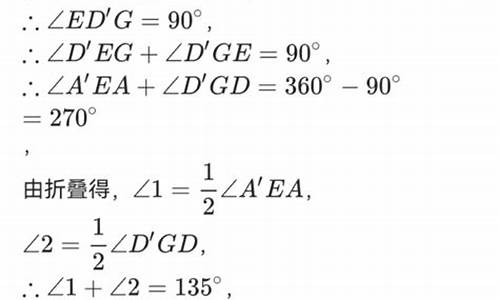
| 解:(1)∵函数 的图象顶点为C(1,-2), ∴函数关系式可表示为 , | |
| (2)设直线PE对应的函数关系到式为 , 由题意知四边形ACBD是菱形,故直线PE必经过菱形的中心M, 由P(0, -1),M(1, 0)得: ?解之,得 , ∴直线PE对应的函数关系式为 , 联列方程组,得: 解之,得 , 得点E(3, 2)。 | |
| (3)设存在这样的点F,设 ,过点F作FG⊥y轴垂足为点G, 在Rt△POM和△FGP中, ∵ , ∴ , 又 , ∴ , ∴ , 又 , ∴ , 解得, (不合题意,舍去),x 2 =1故得点 , 以上各步皆可逆,故点 即为所求, ∴ 。 |
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,
A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,①反应C+G
| 高温 |
| ||
| ? |
(1)①中反应的化学方程式为:2Al+Fe2O3
| ||
| ? |
| ||
| ? |
(2)二氧化碳分子是直线型化合物,碳原子和氧原子间形成两对共用电子对,分别形成两个共价键;电子式是把原子最外层电子标注在元素符号周围,二氧化碳的电子式为:,故答案为:;直线型;
(3)1.6g G 溶于盐酸,发生的反应为:Fe2O3+6HCl=2FeCl3+3H2O,得到的溶液与铜粉完全反应,1.6g G 为Fe2O3物质的量为0.01mol,含Fe3+离子物质的量为0.02mol;溶解铜发生反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;至少需要的铜物质的量为0.01mol,铜的质量为0.64g,
故答案为:0.64g;
(4)C为Al与过量NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后溶液为偏铝酸钠溶液与过量化合物Ⅰ(CO2)反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)E为(Mg)在I(CO2)中燃烧,观察到的现象是镁条剧烈燃烧生成白色和黑色固体,反应的化学方程式为:2Mg+CO2
| ||
| ? |
故答案为:镁条剧烈燃烧生成白色和黑色固体.
已知A~H均为初中化学常见的物质。A为一种金属单质。C与D均为固体.G为红褐色沉淀.H为含两种元素
(1)A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,则A为Mg,D为C,反应①为Mg与C02的反应,F的浓溶液与A、D反应都有红棕色气体生成,F为浓硝酸,C为MgO;
A为Mg,原子核外有3个电子层,最外层电子数为2,原子结构示意图为,反应④为C与浓硝酸的反应为C+4HNO3(浓)
| ||
| ? |
故答案为:;C+4HNO3(浓)
| ||
| ? |
(2)若A是常见的变价金属的单质,D、F是气态单质,A是Fe,反应①②均在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2;
反应②的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+,若11.2g的A与足量的B反应,发生Fe+2HCl=FeCl2+H2↑,则产生气体的在标准状况下的体积为
| 11.2g |
| 56g/mol |
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则A为C,D为Si,F为O2,反应①为C与二氧化硅的反应,该化学反应为SiO2+2C
| ||
| ? |
| ||
| ? |
下图中的A→K分别代表初中化学中的常见物质.已知:A、C两物质组成元素相同; G溶液为某物质的稀溶液,G
两种固体反应得到一种金属,马上想到是高温下木炭冶炼金属的氧化物。再从后面红褐色沉淀可以看出,金属就是Fe,所以两种固体就是C和Fe2O3。而C可以发生后续的反应得到G,说明C中含Fe元素,所以C是Fe2O3,D是C。又因为H是只含两种元素的钠盐,初中你学过的就是NaCl,所以I是HCl。
E是FeCl3,F就是NaOH,它与HCl的反应是酸碱中和反应,是复分解反应。
FeCl3+NaOH的方程自己写。
若D是气体,那就是CO还原Fe2O3,自己写。
A~E是初中化学常见的物质,已知A和E都可以作燃料,其中A是天然气的主要成分.(1)反应①的化学方程式为
(1)I为蓝色溶液可以判断I为铜盐的溶液,而J可以和铜盐溶液反应生成金属单质E,根据金属活动性顺序的应用可以知道:E为铜单质,而J可能为铁等活泼金属;
(2)C可以在电解的作用下反应生成气体单质D和F,所以可以判断C为水,而A能够和黑色粉末反应生成C和D,所以可以判A为过氧化氢,而D为氧气,那么F为氢气,黑色粉末B为二氧化锰,金属单质E可以和氧气反应生成黑色固体,所以可以判H为氧化铜,H可以和G反应生成蓝色溶液I,那么G为硫酸或盐酸,所以I为硫酸铜或是氯化铜,J可以和I反应生成铜单质,所以J为铁等比铜活泼的金属,I和碱反应生成K,所以K为氢氧化铜沉淀;
所以 ①C→F的反应为水生成氢气和氧气的反应,可以写出该反应的化学方程式:2H2O
| ||
| ? |
②I→E的反应为硫酸铜生成铜的反应,故可以写出该反应的化学方程式:Fe+CuSO4═FeSO4+Cu;
③I和碱→K的反应应该为硫酸铜和氢氧化钠溶液的反应,故可以写出该反应的化学方程式:CuSO4+2NaOH═Na2SO4+Cu(OH)2↓;
(3)根据(2)的解答可以知道D为氧气,所以根据实验室中制取氧气的反应原理可知高锰酸钾也可以分解产生氧气.
故答案为:(1)Fe;
(2)①2H2O
| ||
| ? |
②Fe+CuSO4═FeSO4+Cu;
③CuSO4+2NaOH═Na2SO4+Cu(OH)2↓;
(3)2KMnO4
| ||
| ? |
A、B、C、D、E、F、H、I、M为初中化学常见的物质,且有如下的转化关系.已知A、B含有相同元素,B、D、H、
“A是天然气的主要成分”可知,A为甲烷,化学式为CH4,燃烧需要氧气,B是氧气;甲烷经过燃烧产生二氧化碳和水,D能够电解,因此D是水,C是二氧化碳;电解水产生的E可以做燃料,则E是氢气;
(1)反应①是甲烷燃烧的方程式为:CH4+2O2
| ||
| ? |
(2)反应②是水通电产生氢气和氧气,属于分解反应;
(3)E是氢气,作燃料的优点是:产物无污染(或燃烧热值高等).
故答案为:(1)CH4+2O2
| ||
| ? |
已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相
(1)已知A、B含有相同元素,并且M不变,因此M是催化剂,起的作用是催化作用,反应是过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,因此A是过氧化氢,B是水,C是氧气;E为黑色固体单质,碳和氧气在点燃的条件下生成二氧化碳,反应②是实验室检验二氧化碳的反应,因此是二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,所以H是二氧化碳,F是氢氧化钙,I是碳酸钙;故答案为:催化作用;H2O2;CaCO3
(2)二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,故答案为:Ca(OH)2+CO2=CaCO3↓+H2O
(3)二氧化碳的用途有:①二氧化碳既不能燃烧也不能支持燃烧,因此二氧化碳能够灭火;②二氧化碳可以做化工原料,如制汽水等;③二氧化碳的固体干冰,可以进行人工降雨,也可以做制冷剂;④二氧化碳促进绿色植物的光合作用,因此可以做气体肥料;故答案为:气体肥料(灭火等合理即可)
A~L为中学化学常见的物质,其主要转化关系如图所示(其中产物水已略去).已知A为常见的金属单质,C、D
B是相对分子质量最小的氧化物,根据已有知识可以确定B是水,其化学式为H2O;C、D是化合物,它们分别是由碳、氢、氧三种元素中几种组成,D物质很不稳定,容易分解生成水和C,可以确定D是碳酸,其化学式为:H2CO3;C为二氧化碳,E、F是单质,均可以与A反应,分别生成水和二氧化碳,确定A是氧气,其化学式为:O2;E是氢气,其化学式为:H2;F是碳;
(2)由(1)的解答可以知道,A+F→C的反应为氧气和碳的反应,该反应生成了二氧化碳,其文字表达式为:碳+氧气
| 点燃 |
| ||
| ? |
故答案为:(1)O2;H2O;H2CO3;H2;
(2)碳+氧气
| 点燃 |
| ||
| ? |
A-L为中学化学常见物质,C、D通常状况下为气体单质,F为具有刺激性气味的气体,F为重要的化工产品,则F是NH3,由C+D→F,所以C和D一种是氮气,另一种是氢气,A是金属单质,A+B的稀溶液→E+C,所以C是H2,D是N2;
G和I分别由相同的两种元素组成,通常状况下均为无色液体,G和I一种是水,一种是双氧水,由E和G反应生成H可知,E和H都含有金属A元素,故A是变价金属,A是铁,E是亚铁盐,H是铁盐,G是H2O2,I是H2O;
转化关系H+I+F为铁盐+氨水→Fe(OH)3+铵盐,所以J和K一种是Fe(OH)3,一种是铵盐,结合将一定量的F通入B的溶液中,可得到两种盐K和L可知,B为二元酸,B为重要的化工产品,则B是H2SO4,K为(NH4)2SO4,J为Fe(OH)3.
(1)通过以上分析知,B的化学式是H2SO4,A是铁,工业上冶炼金属Fe,主要利用一氧化碳含有氧化铁,该冶炼方法称为热还原法,故答案为:H2SO4,热还原法;?
(2)硫酸亚铁和氢氧化钠反应生成硫酸钠和氢氧化亚铁白色沉淀,但氢氧化亚铁不稳定,立即变为灰绿色,最后生成红褐色沉淀,所以反应现象是先生成白色沉淀,迅速变为灰绿色,最后变为红褐色,反应方程式为FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe?(OH)3;
故答案为:先生成白色沉淀,迅速变为灰绿色,最后变为红褐色;FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe?(OH)3;
(3)酸性条件下,亚铁离子和双氧水反应生成铁离子和水,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)检验铁离子所用试剂是硫氰化钾溶液,向含有铁离子的溶液中加入硫氰化钾溶液,溶液由**变为血红色,故答案为:硫氰化钾溶液,溶液由**变为血红色;
(5)将一定量的氨气通入硫酸的溶液中,可得到两种盐硫酸铵和硫酸氢铵,物质的量浓度相同的硫酸铵和硫酸氢铵的溶液,硫酸铵水解导致其溶液呈酸性,硫酸氢铵是强酸的酸式盐,水溶液呈强酸性,所以在相同条件下pH相对较大的为(NH4)2SO4,
故答案为:>;NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。