氯气和金属单质反应化学方程式_氯气和金属单质反应
1.氯气都和什么反应,生成什么
2.氯及其化合物的性质
3.氯气与足量金属反应
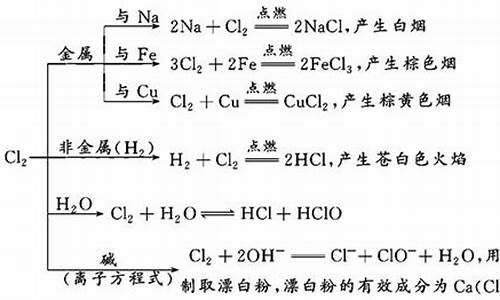
1、现象:钠在氯气里剧烈燃烧,产生大量的白烟,放热。2Na+Cl2=点燃=2NaCl
2、现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕**的烟,加少量水后,溶液呈蓝绿色。Cu+Cl2=点燃=CuCl2
3、现象:铁丝在氯气里剧烈燃烧,瓶里充满棕红色烟,加少量水后,溶液呈**。 2Fe+3Cl2=点燃=2FeCl3与金属反应
4、与氢气的反应
H2+Cl2=点燃=2HCl(工业制盐酸方法,工业先电解饱和食盐水,生成的氢气和氯气燃烧生成氯化氢气体)现象:H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口处出现白雾。
H2+Cl2=光照=2HCl 现象:见光爆炸,有白雾产生。
5、与磷的反应
2P+3Cl2(少量)=点燃=2PCl3(液体农药,雾)
2P+5Cl2(过量)=点燃=2PCl5(固体农药,烟) 现象:产生白色烟雾
氯气都和什么反应,生成什么
铝和氯气反应如下:
铝和氯气反应是一种重要的化学反应,通常在常温常压下进行。这个反应中,铝原子与氯气分子中的氯原子发生键合,生成氯化铝。这个反应是非常重要的,因为它在很多化学工业过程中都得到了应用,例如制造塑料、农药、漂白剂等。
在标准状态下,这是一个放热反应,反应过程中会释放出大量的热能。这个反应也是路易斯酸碱反应的一种,其中铝原子作为路易斯碱,氯气分子作为路易斯酸。
铝和氯气反应非常明显,通常会伴随剧烈的燃烧和发出明亮的白光。在反应过程中,铝原子会失去三个电子,而每个氯原子则会得到一个电子,形成稳定的氯化铝。
这个反应是可逆的,如果改变反应条件,比如增加温度或者改变压力,则可以使得反应向相反方向进行,生成铝和氯气。
氯化铝是一种非常重要的化合物,它在水溶液中是一种强酸,也称为氢氯酸。氯化铝可以用于制造其他化学品,例如聚氯化铝、氯化铝分解涂料等。此外,氯化铝还可以用于电镀、造纸、纺织等工业领域。
除了铝和氯气反应本身,这个反应还有一些重要的。首先,这个反应可以用于制备高纯度的铝单质。通过将铝粉和氯气反应,可以制备出高纯度的氯化铝,然后再通过电解还原的方法将其还原为高纯度的铝单质。
其次,这个反应还可以用于制备其他金属氯化物。例如,将铝和氯化铁反应可以制备出氯化铁。此外,铝和氯气反应还可以用于制备其他含氯化合物,例如次氯酸、氯代烃等。
此外,铝和氯气的反应还可以用于制备其他金属氯化物。例如,将铝和氯化铁反应可以制备出氯化铁。氯化铁是一种重要的工业原料,可以用于制造染料、农药、医药等。
此外,铝和氯化铜也可以反应,制备出氯化铜。氯化铜是一种常见的催化剂和电极材料,可以用于制造电池、电解槽等。
另外,铝和氯气的反应还可以用于制备其他含氯化合物。例如,将铝和次氯酸反应可以制备出次氯酸。次氯酸是一种强氧化剂,可以用于漂白、消毒等应用。此外,将铝和氯气反应还可以制备出氯代烃。氯代烃是一种重要的有机化工原料,可以用于制造农药、医药、香料等。
总之,铝和氯气反应是一种非常重要的化学反应,它在化学工业中得到了广泛的应用。通过了解这个反应的原理和,我们可以更好地理解化学反应的本质和应用,同时也为相关领域的研究和应用提供一些参考和启示。
氯及其化合物的性质
和金属单质反应:1、和钠反应生成氯化钠; 2、和Fe反应生成氯化铁 3、和铜反应生成氯化铜;和非金属单质反应:1、和氢气反应生成氯化氢 2、和硫单质反应生成硫化氢 3、和磷单质反应生成三氯化磷和五氯化磷
氯气与足量金属反应
氯气与金属的反应(大多数金属都能在氯气中燃烧)。
示例:2Fe+3Cl2==2FeCl3
Cu+Cl2==CuCl2
2Na+Cl2==2NaCl
氯气与非金属的反应。
氯气与水的反应。
Cl2+H2O==HCl+HClO
2HClO(光照)=== 2HCl+O2↑
氯气与碱的反应。
Cl2+2NaOH==NaCl+NaClO+H2O
(1)漂的制取:
2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
(2)漂白原理:
Ca(ClO)2+H2O+CO2==CaCO3↓+2HClO
或Ca(ClO)2+2HCl==CaCl2+2HClO
氯气的物理化学性质
(1)氯气是黄绿色有毒气体,可溶于水,比空气重。
(2)氯气化学性质比较活泼,能与金属、非金属、水和碱等反应。
(3)次氯酸是一种弱酸,具有较强的氧化性,有漂白性和消毒杀菌作用,见光易分解。
氯气的实验室制备
(1)药品:MnO2固体和浓盐酸。
(2)原理:MnO2+4HCl(浓)加热MnCl2+Cl2+2H2O
(3)装置:下图是实验室制取氯水及干燥纯净氯气的实验装置。
a:氯气的发生装置(分液漏斗内装浓盐酸,烧瓶内装MnO2固体)。 b:除杂装置(内装饱和食盐水以除去挥发出来的氯化氢气体)。 c:制取氯水装置(内装蒸馏水)。 d:干燥装置(内装浓硫酸)。 e:收集装置(用向上排气法收集干燥氯气)。 f:尾气处理装置(内装氢氧化钠溶液以吸收多余的氯气)。 g:氯气的检验:用湿润的淀粉碘化钾试纸。(试纸变蓝)。氯离子的检验
方法:在被检验的溶液中加稀硝酸酸化,再滴加AgNO3溶液,若出现白色沉淀,则被检验的溶液中含有Cl-。
Ag++Cl-==AgCl↓
注:对上述方法有干扰的离子有SO42-、SO32-。
卤素元素的活泼性比较
卤素元素:氟、氯、溴、碘其单质的氧化性强弱顺序为:F2>Cl2>Br2>I2
例如:Cl2+2NaBr==Br2+2NaCl
Cl2+2KI==I2+2KCl
Br2+2KI==I2+2KBr
首先明确这些反应是氧化还原反应就好办了!
0.15mol的Cl2中有0.3mol的Cl原子,反应后变为Clˉ,关系式如下:
Cl+eˉ=Clˉ
1~~1
0.3~0.3
所以全部反应需要0.3mol的电子转移,而这里有0.1mol的金属单质,所以该金属和Cl2反应后的化合物中金属元素为0.3/0.1=+3价
这里就可以排除AB了!~
硫那个也一样,列出还原反应的关系式:
S+2eˉ=(S)2ˉ
1~2
0.1~0.2
所以全部反应需要0.2mol的电子转移,,而这里有0.1mol的金属单质,所以该金属和S反应后的化合物中金属元素为0.2/0.1=+2价
到这里就没问题了,因为Al元素没见过+2价,所以答案是铁,选D。这里只有铁有+3和+2价!
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。