某金属单质_某金属单质具有体心立方结构
1.求高中化学大神总结下各种高中化学常见物质还原性氧化性强弱排序
2.关于金属单质能和哪些物质反应的问题,希望能回答全面一点
3.某课外小组对一些金属单质和化合物的性质进行研究.(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
4.金属单质有哪些
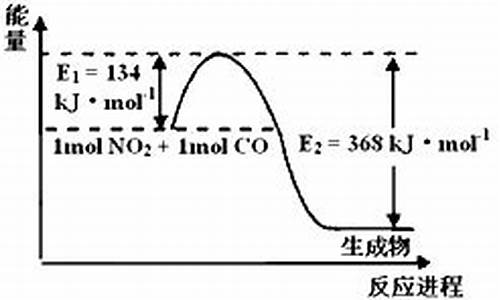
某银白色金属单质A在空气中加热燃烧时发出**火焰,说明含有钠元素,A在空气中燃烧得到淡**固体B,则A是Na,B是Na2O2,钠露置在空气中足够长时间变为Na2CO3,所以C是Na2CO3,过氧化钠和酸性气体反应生成Na2CO3,则D是CO2.
(1)①钠密度小于水,所以钠浮在水面上;
②钠的熔点低,钠和水反应放热,所以钠熔成闪亮的小球;
③钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声,所以小球在水面上四处游动,并发出咝咝声;
④反应后溶液生成氢氧化钠,方程式:2Na+2H2O=2NaOH+H2↑,溶液呈碱性,遇到酚酞溶液变红;
故答案为:
| 现象 | 分析(原因) |
| 钠浮在水面上 | 钠密度小于水 |
| 钠熔成闪亮的小球 | 钠的熔点低,钠和水反应放热 |
| 小球在水面上四处游动,并发出咝咝声 | 钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声 |
| 溶液变红色 | 反应后溶液生成氢氧化钠,溶液呈碱性,酚酞试液遇碱变红色 |
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Cl2+2NaOH=NaCl+NaClO+H2O.
求高中化学大神总结下各种高中化学常见物质还原性氧化性强弱排序
金属单质与非金属单质之间的反应金属会失去电子,形成阳离子,而非金属会接受电子,形成阴离子。
反应说明:
当金属与非金属发生反应时,通常会产生离子化合物。以钠和氯气的反应为例,钠是一种金属单质,氯是一种非金属单质。钠原子会失去一个电子,形成钠离子(Na+),而氯原子会接受一个电子,形成氯离子(Cl-)。
这两种离子会结合在一起形成氯化钠(NaCl),这是一种常见的离子化合物,也就是我们日常生活中使用的食盐。
共价键的形成:
除了离子化合物的形成,金属单质与非金属单质之间还可以发生共价键的形成。共价键是一种化学键,通过电子的共享来形成。
氧气和氢气的反应就是通过共价键的形成来实现的。氧气是一种非金属单质,氢气也是一种非金属单质。当氧气和氢气反应时,氧原子和氢原子会共享电子,形成水分子(H2O)。在水分子中,氧原子与氢原子通过共价键连接在一起。
金属单质与非金属单质之间的反应的意义:
1.形成新的化合物
金属单质与非金属单质之间的反应通常会形成新的化合物,这些化合物具有不同的性质和用途。这为人们开发新材料和应用提供了广阔的空间。
2.提供新的能源
某些金属单质与非金属单质之间的反应可以释放出大量的能量,如金属与非金属的燃烧反应。这些反应可以用来作为能源,如金属燃料电池的应用。
3.促进科学研究和技术进步
金属单质与非金属单质之间的反应是化学研究和技术发展的重要基础。通过研究这些反应,人们可以深入了解元素之间的相互作用和反应机制,进一步推动科学的发展。
4.扩展应用领域
金属单质与非金属单质之间的反应可以开发出各种具有特殊性质和功能的材料,如合金、陶瓷等。这些材料广泛应用于建筑、电子、航空航天等领域,推动了社会的进步和发展。
5.提供化学反应的多样性
金属单质与非金属单质之间的反应具有多样性,可以发生不同类型的反应,如离子化合物的形成、共价键的形成等。这种多样性丰富了化学反应的研究内容,拓宽了化学反应的应用领域。
关于金属单质能和哪些物质反应的问题,希望能回答全面一点
金属还原性:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)>Cu>Hg>Ag>Pt>Au
典型还原剂
活泼的金属单质:如Na,Al,Zn,Fe等.
活泼的金属氢化物:如氢化铝锂LiAlH4
某些非金属单质:如H2,C,Si等.元素(如C,S等)
碱金属单质:如Li,Na,K等
处于低化合价时的氧化物:如CO,SO2等.元素(如Cl,S等)
处于低化合价时的酸:如HCl,H2S等.元素(如Fe,S等)
处于低化合价时的盐:如Na2SO3,FeSO4等.
氯化亚锡SnCl2,草酸,硼氢化钾KBH4,硼氢化钠NaBH4,
离子氧化性与还原性相反,需要注意的是 Fe 3+>Cu2+>Fe2+
常见的氧化剂是在化学反应中易得电子被还原的物质也称作还原反应。
(1)典型的非金属单质如F2、O2、Cl2、Br2、I2、S等(其氧化性强弱与非金属活动性基本一致)。
(2)含有变价元素的高价化合物,如KMnO4、KClO3、浓 H2SO4 、HNO3、MnO2 、FeCl3等。
(3)金属阳离子如:Fe3+、Cu2+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO4=FeSO4+Cu中,实质上是Cu2+离子氧化Fe原子,Cu2+作氧化剂,Fe是还原剂)
常见的还原剂是在化学反应中易失电子被氧化的物质,也称作氧化反应。
(1)典型的金属单质如:K、Ca、Na、Mg等(其还原性强弱与金属活动性基本一致)
(2)有变价元素的最低价态化合物如:H2S、HI、HBr、HCl
(3)非金属阴离子如:S2-、I-、Br-、Cl- 还有被称为“绿色氧化剂”的过氧化氢(H2O2),俗称双氧水,在有催化剂的条件下,它能迅速分解,生成氧气和水。
编辑本段氧化剂的分类
氧化剂按照化学组成分为无机氧化剂和有机氧化剂。又可按照氧化反应所要求的介质分为以下3类:
(1)酸性介质氧化剂(过氧化氢、过氧乙酸、重铬酸钠、铬酸、硝酸、高锰酸钾、过硫酸铵)。
(2)碱性介质氧化剂(次氯酸钠、过碳酸钠、过硼酸钠、过硼酸钾)。
(3)中性氧化剂(溴、碘)。
某课外小组对一些金属单质和化合物的性质进行研究.(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
金属我们学的主要有:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au。前三种都可以和水,酸反应,而Mg可以与热水反应,与冷水不反应,在H前面的金属都可以和酸反应,Al是一种特别的金属,具有也就是说,它既能和酸也能和碱反应。H后面的既不能和酸也不能和碱反应。
金属单质有哪些
(1)将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,反应为2Al+3CuCl2=3Cu+2AlCl3,
离子方程式为:2Al+3Cu2+═2Al3++3Cu 红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为2Cu+O2+CO2+H2O=Cu2(OH)2CO3,
故答案为:2Al+3Cu2+═2Al3++3Cu;2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(2)实验分离出的溶液是氯化铝溶液,惰性电极电解阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,附近氢氧根离子和铝离子反应生成氢氧化铝沉淀,随氢氧根离子浓度增大,氢氧化铝可以溶解于碱中,反应的离子方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:有白色沉淀生成,后沉淀逐渐溶解至消失;Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(3)①高温时,铝与二氧化锰发生置换反应生成锰,反应的方程式为3MnO2+4Al
| ||
| ? |
| ||
| ? |
②根据氧化还原反应可知Mn由+4价变为+2价,氧化合价肯定升高,所以产物有氧气生成,反应为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
金属单质有铝、镁、钾、钠、钙、锶、钡、铜、铅、锌、锡、钴、镍、锑等等,单质包括金属单质、非金属单质和稀有气体等等,单质是由同种元素组成的纯净物。
地球上的金属广泛地存在于地壳和海洋中,除少数很不活泼的金属如金、银等有单质形式存在外,其余都以化合物的形式存在。金属在自然界中广泛存在,在生活中应用极为普遍。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












