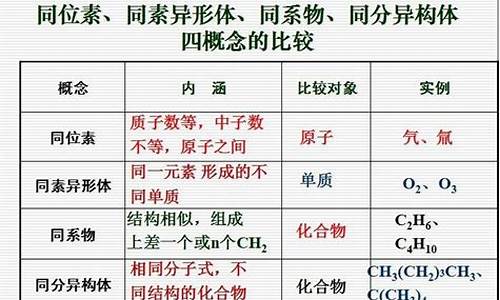
碱和非金属单质反应的例子_碱和非金属单质
1.为什么不少非金属与碱的反应都是歧化反应?
2.金属单质,非金属单质,碱性氧化物,酸性氧化物,酸,碱,盐分别能与哪些类别的物质发生反应?
应该是和卤素单质反应,其他的暂未想到
举例,NaOH与Cl2(其他类似)条件是一般的常温下即可
2NaOH+Cl2=NaCl+NaClO+H2O
事实上是Cl2先于水发生可逆反应Cl2+H2O=HCl+HClO
然后NaOH与两种生成物均反应促进了原反应源源不断的进行
若是Ca(OH)2与Cl2,则生成CaCl2与Ca(ClO)2
若是KOH与Br2,则生成KBr与KBrO
为什么不少非金属与碱的反应都是歧化反应?
能和碱液反应的非金属单质有卤素和硅。
卤素的反应(以氯为代表):Cl2+2NaOH==NaCl+NaClO+H2O
硅的反应:Si+2NaOH+H2O==Na2SiO3+2H2
金属单质,非金属单质,碱性氧化物,酸性氧化物,酸,碱,盐分别能与哪些类别的物质发生反应?
你想啊:
因为非金属的化合价是0,如果它要和碱反应,它的化合价必须得改变,否则它就不能成为化合物。
如果它要成为化合物,它的化合价必须改变,也就意味着它必须从环境中得到或失去电子。而环境中,作为反应物的元素只有H O 和碱金属。要改变H的化合价只有单质的金属性比H强才行,这是普通非金属所不行的。当然,碱金属就更不能被非金属所还原。
类似的,O 的化合价的改变只有是 被氧化,使它失去电子。这也是普通非金属化合物所不能做到的。
所以,如果某种单质如果不发生歧化反应的和碱反应,它的金属性比氢强或非金属性比氧强才行。普通非金属显然是不行的,因为它们的还原性和氧化性都只能位于氢氧之间。如果位于这个范围之外,如氟就可以不发生歧化反应,和碱反应。
否则只能是通过改变非金属单质内部自身的化合来实现从单质变为化合物。这就是歧化反应。
金属单质与非金属单质反应:Mg+Cl2--->MgCl2
碱性氧化物与酸性氧化物反应:Na2O+CO2--->Na2CO3
酸与碱反应:HCl+NaOH--->NaCl+H2O
金属单质与酸反应:Fe+2HCl--->FeCl2+H2
非金属单质与碱反应:Cl2+2NaOH--->NaCl+NaClO+H2O
碱性氧化物与酸反应:Na2O+2HCl--->2NaCl+H2O
酸性氧化物与碱反应:CO2+2NaOH--->Na2CO3+H2O
酸与盐反应:HCl+AgNO3--->AgCl+HNO3
碱与盐反应:2NaOH+CuSO4--->Cu(OH)2+Na2SO4
盐与盐反应:BaCl2+Na2SO4--->BaSO4+2NaCl
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












