某金属单质_某金属单质具有体心立方结构原子量
1.某课外小组对一些金属单质和化合物的性质进行研究.(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
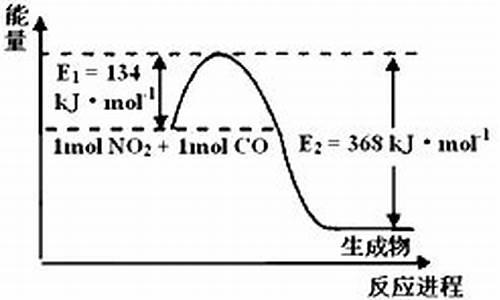
某银白色金属单质A在空气中加热燃烧时发出**火焰,说明含有钠元素,A在空气中燃烧得到淡**固体B,则A是Na,B是Na2O2,钠露置在空气中足够长时间变为Na2CO3,所以C是Na2CO3,过氧化钠和酸性气体反应生成Na2CO3,则D是CO2.
(1)①钠密度小于水,所以钠浮在水面上;
②钠的熔点低,钠和水反应放热,所以钠熔成闪亮的小球;
③钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声,所以小球在水面上四处游动,并发出咝咝声;
④反应后溶液生成氢氧化钠,方程式:2Na+2H2O=2NaOH+H2↑,溶液呈碱性,遇到酚酞溶液变红;
故答案为:
| 现象 | 分析(原因) |
| 钠浮在水面上 | 钠密度小于水 |
| 钠熔成闪亮的小球 | 钠的熔点低,钠和水反应放热 |
| 小球在水面上四处游动,并发出咝咝声 | 钠立即与水剧烈反应,并有氢气产生,同时H2燃烧时产生发出的爆鸣声 |
| 溶液变红色 | 反应后溶液生成氢氧化钠,溶液呈碱性,酚酞试液遇碱变红色 |
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Cl2+2NaOH=NaCl+NaClO+H2O.
某课外小组对一些金属单质和化合物的性质进行研究.(1)下表为“铝与氯化铜溶液反应”实验报告的一部分
解析:
22.
(1)C:Na2CO3、D:CO2、E:NaOH
(2)①2Na + 2H2O ―→ 2NaOH + H2↑
②2Na2O2 + 2CO2 ―→ 2Na2CO3 + O2
③Cl2 + 2NaOH ―→ NaCl + NaClO + H2O
23.设生成的NaOH质量为 x g,O2质量为 y g,则有:
2Na2O2 + 2H2O ―→ 4NaOH + O2↑
78×2 40×4 32
7.8 g x g y g
解得:x = 8 g,y = 1.6 g
所以NaOH物质的量 = 8 g / 40 g/mol = 0.2 mol
标况下O2体积 =( 1.6 g / 32 g/mol)× 22.4 L/mol = 1.12 L
(1)将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,反应为2Al+3CuCl2=3Cu+2AlCl3,
离子方程式为:2Al+3Cu2+═2Al3++3Cu 红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为2Cu+O2+CO2+H2O=Cu2(OH)2CO3,
故答案为:2Al+3Cu2+═2Al3++3Cu;2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(2)实验分离出的溶液是氯化铝溶液,惰性电极电解阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,附近氢氧根离子和铝离子反应生成氢氧化铝沉淀,随氢氧根离子浓度增大,氢氧化铝可以溶解于碱中,反应的离子方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:有白色沉淀生成,后沉淀逐渐溶解至消失;Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(3)①高温时,铝与二氧化锰发生置换反应生成锰,反应的方程式为3MnO2+4Al
| ||
| ? |
| ||
| ? |
②根据氧化还原反应可知Mn由+4价变为+2价,氧化合价肯定升高,所以产物有氧气生成,反应为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












