碱金属单质的熔沸点为什么逐渐降低_碱金属单质的熔沸点
1.碱金属的熔沸点变化规律是什么?
2.为什么卤素原子的熔沸点随着原子半径增大而增大而碱金属却相反
3.单质的熔沸点怎么比较?
4.为什么碱金属熔沸点随半径的增大而减小?
金属(jiǎn jīn shǔ)是元素周期表中第IA族元素锂、钠、钾、铷、铯、钫六种金属元素的统称,也是它们对应单质的统称。(钫因为是放射性元素所以通常不予考虑)因它们的氢氧化物都易溶于水(除LiOH溶解度稍小外),且呈强碱性,故此命名为碱金属。氢虽然是第IA族元素,但它在普通状况下是双原子气体,不会呈金属状态。只有在极端情况下(1.4兆大压力),电子可在不同氢原子之间流动,变成金属氢。
碱金属盐类溶解性的最大特点是易溶性,它们的盐类大都易溶于水。已知LiF,Li2CO3,Li3PO4及固体Li2SiO3是难溶(微溶)的,少数大的阴离子的碱金属盐也是难溶的,如Na2C2H5N4O3(脲酸钠)、Na[Sb(OH)6](六羟基合锑酸钠)、K2PtCl6(氯铂酸钾)、KClO4(高氯酸钾)、KHC4H4O6(酒石酸氢钾)等。它们在溶液中完全电离。
碱金属都是银白色的(铯略带金**),比较软的金属,密度比较小,熔点和沸点都比较低。他们生成化合物时都是正一价阳离子,碱金属原子失去电子变为离子时最外层一般是8个电子,但锂离子最外层只有2个电子。
在古代埃及把天然的碳酸钠叫做neter或nitrum,在洗涤时使用。14世纪时,阿拉伯人称植物的灰烬为kali,逐渐演变到叫做碱,但这时钠和钾的区别还不清楚,统称为苏打(soda)。一直到18世纪才分清从食盐得到的泡碱和从植物灰得到的钾碱不是同一种东西。
碱金属都能和水发生激烈的反应,生成强碱性的氢氧化物,随原子量增大反应能力越强。在氢气中,碱金属都生成白色粉末状的氢化物。碱金属都可在氯气中燃烧,而碱金属中只有锂能在常温下与氮气反应。由于碱金属化学性质都很活泼,为了防止与空气中的水发生反应,一般将他们放在煤油或石蜡中保存。
碱金属都是活泼金属。碱金属单质以金属键相结合。因原子体积较大,只有一个电子参加成键,所以在固体中原子间相互作用较弱。碱金属的熔点和沸点都较低,硬度较小(如钠和钾可用小刀切割)。
碱金属元素原子的价电子层结构是ns1,因此化合价为+1。碱金属原子次外层有8个电子(锂是2个电子),对核电荷的屏蔽效应较强,最外层的一个价电子离核又较远,特别容易失去。跟同周期的其他元素相比,碱金属原子半径最大(除稀有气体元素外),第一电离能最低,电负性最小。碱金属在成键形成化合物时,以离子键为特征。
碱金属在自然界中都以化合态存在。它在化学反应中常用作还原剂。
碱金属的一般保存方法:
锂:液体石蜡封
钠、钾:放入煤油
铷、铯:保存在真空玻璃管中
铷和铯又都是又轻又软的金属,用小刀可以毫不费力地切开它们。铯在28℃时熔化,在常温下呈现半液体状。铷的熔点是38℃,在常温下呈糊状。在金属家族中,它们是“软骨头”。
这两种元素的另一个特殊本领是:它们都对光线特别敏感,即使在极其微弱的光线照射下,它们也会放出电子来。把铷和铯喷镀到银片上,即可制成“光电管”——一受光照,它便会产生电流,光线越强,电流越大。在自动控制技术中,光电管就象是机器的“眼睛”,所以有人把铷和铯叫做“长眼睛的金属”。
铷,化学符号Rb,原子序数37,原子量85.4678,属元素周期表第IA族,为碱金属的成员和稀有金属。1861年德国R.W.本生和G.R.基尔霍夫从萨克森地方的锂云母中提取溶液,然后用光谱分析发现一种新的碱金属元素,取名rubidium,该字来源于希腊文rubidus,含义是“最深的红色”。铷在地壳中的含量为0.028%,但极其分散,至今尚未发现单纯的铷矿物,而是存在于其他矿物中,铷在锂云母中的含量为3.75%;铷在光卤石中的含量虽不高,但储量很大;海水中含铷量为0.121克/吨。铷有两种天然同位素:铷85和铷87,后者具有放射性。
铷是银白色金属,质软,可用小刀切割。熔点38.89℃,沸点686℃,密度1.532克/厘米3(20℃)。化学性质比钾还要活泼,在室温和空气中能自燃,因此必须在严密隔绝空气情况下保存在液体石蜡中。铷与水,甚至是与温度低到-100℃的冰相接触时,也能发生猛烈反应,生成氢氧化铷和氢气。与有限量氧气作用,生成氧化铷,在过量氧气中燃烧,生成超氧化物。铷也能与卤素反应。氧化态为+1,只生成+1价化合物。铷离子能使火焰染成紫红色,可用焰色反应和火焰光度计检测。
由于铷非常活泼,不能用电解法生产,而要用金属热还原法。用钙还原氯化铷,用镁还原碳酸铷,都可以制得金属铷。铷在光的作用下易放出电子,可用于制造光电池。和钾、钠、铯形成的合金可用于除去高真空系统的残余气体。碘化铷银是良好的电子导体,可用作固体电池的电解质。铷的特征共振频率为6835兆赫,可用作时间标准,铷原子钟的特点是体积小、重量轻、所需功率小。 周期律性质
主条目:元素周期律
碱金属位于ⅠA族,其周期律性质主要表现为
·自上而下,碱金属元素的金属性逐渐增强
·每一种碱金属元素都是同周期元素中金属性最强的元素
锂的特殊性
锂的反常性
ⅠA族的周期性十分明显,但锂还是和同族的其它碱金属元素有很大不同,这种不同主要表现在锂化合物的共价性,这是由锂的原子半径过小导致的。
锂-镁对角线规则
主条目:对角线规则
元素周期表中,碱金属锂与位于其对角线位置的碱土金属镁(Mg)存在一定的相似性,这里体现了元素周期表中局部存在的“对角线规则”。锂与镁的相似性表现在:
·单质与氧气作用生成正常氧化物
·单质可以与氮气直接化和(和锂同族的其它碱金属单质无此性质)
·氢氧化物为中强碱,溶解度小,加热易分解
·氟化物、碳酸盐、磷酸盐难溶于水
·碳酸盐受热易分解
·氯化物能溶于有机溶剂中(共价性)
·锂离子、镁离子的水合能力强
究其原因,锂-镁对角线规则可以用周期表中离子半径的变化来说明,同一周期从左到右,离子半径因有效电荷的增加而减少,同族元素自上而下离子半径因电子层数的增加而增大,锂与镁因为处于对角线处,镁正好在锂的“右下方”,其离子半径因周期的递变规律而减小,又因族的递变规律而增大,二者抵消后就出现了相似性。[7]
碱金属的熔沸点变化规律是什么?
单质的熔沸点与单质分子间的作用力大小有关.
碱金属单质的原子以金属键作用,原子序数增大时,原子半径增大,金属键的键长变大,破坏金属键所需的能量减小,所以熔沸点依次降低.
非金属单质是以分子形态出现的,相互间的作用力为范德华力(就是分子间的作用力),原子序数增大时,分子量也增大,分子间的作用力就增大,所以熔沸点逐渐升高.
为什么卤素原子的熔沸点随着原子半径增大而增大而碱金属却相反
碱金属一般熔点较低,随原子序数增加熔沸点降低。与水反应时,由于熔点低,碱金属大多会熔化成小球。碱金属的熔点、沸点随原子序数增加而降低,因而碱土金属的熔点沸点也会具有这变化规律。
碱金属单质的标准电极电势很小,具有很强的反应活性,能直接与很多非金属元素形成离子化合物,与水反应生成氢气,能还原许多盐类(比如四氯化钛),除锂外,所有碱金属单质都不能和氮气直接化合。
扩展资料:
碱金属离子及其挥发性化合物在无色火焰中燃烧时会显现出独特的颜色,这可以用来鉴定碱金属离子的存在,锂、铷、铯也是这样被化学家发现的,电子跃迁可以解释焰色反应,碱金属离子的吸收光谱落在可见光区,因而出现了标志性颜色。
除了鉴定外,焰色反应还可以用于制造焰火和信号弹。
单质的熔沸点怎么比较?
首先,纠正下知友的问题,对于单个原子去讨论熔沸点是没有意义的,我觉得你想问的应该是卤素和碱金属单质的熔沸点问题。
然后,熔沸点问题本身,针对分子间作用力的,研究单位是分子整体,而不是原子的内部结构。分子间的作用力包括取向力、诱导力、色散力,取向力和诱导力的本质是静电引力,与分子间距离的7次方成反比,只存在于极性分子间;色散力由于原子间无规则运动和震动产生的瞬间电荷导致静电引力,存在于任何分子中,原子半径越大,变形性越大,色散力越大,同时,色散力与分子间距离的7次方成反比,而且,对大多数分子来说,色散力是最主要的。
最后,可以得出以下结论:
①对于卤素单子而言,属于非极性共价物质,分子间的作用力主要为色散力,随着原子半径的增大,色散力增大,与此同时,分子半径也在增大,色散力减小。这两个影响因素互为反作用,前者占据主导地位,因此,卤素分子随原子半径增大熔沸点升高。
②对于碱金属单质,属于金属键构成的物质,分子间的作用力主要为取向力和诱导力,根据静电引力的公式,电荷一定的情况下,原子半径越大,静电引力越小,所以,碱金属单质随着原子半径增大熔沸点反而下降。
为什么碱金属熔沸点随半径的增大而减小?
首先,判断元素单质的熔沸点要先判断其单质的晶体类型,晶体类型不同,决定其熔沸点的作用也不同。金属的熔沸点由金属键键能大小决定;分子晶体由分子间作用力的大小决定;离子晶体由离子键键能的大小决定;原子晶体由共价键键能的大小决定。
所以
第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。
用这样的方法去判断同主族元素的熔沸点递变规律就行了,因为理解才是最重要的。
同周期的话,不太好说了。
通常会比较同一类型的元素单质熔沸点,比如说比较Na、Mg、Al的熔沸点,则由金属键键能决定,Al所带电荷最多,原子半径最小,所以金属键最强,故熔沸点是:Na<Mg<Al。
非金属元素
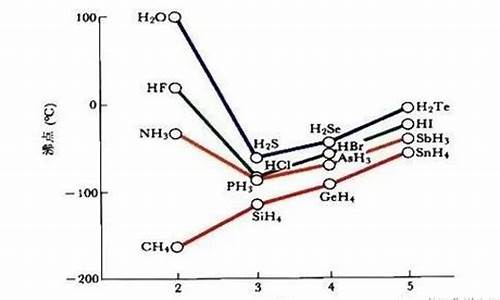
一般不会比较它们单质之间的熔沸点,一般比较他们的氢化物的熔沸点。比较时要注意CH4、NH3、H2O、HF他们的分子间除分子间作用力外,还有氢键,所以同主族氢化物
2
熔沸点他们是最高的,其余的按分子间作用力大小排列。如氧族元素氢化物的熔沸点是:H2O>H2Te>H2Se>H2S;卤素:HF>HI>HBr>HCl。
同周期比较的话,是从左至右熔沸点依次升高,因为气态氢化物的热稳定性是这样递变的。
另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢。
还有原子晶体的:比较金刚石、晶体硅、碳化硅的熔沸点,那就要看共价键了,原子半径越小,共价键键能越大,故熔沸点:金刚石>碳化硅>晶体硅。
展开
因为碱金属的原子体积较大(因为碱金属在元素周期表第一列,所以在同排元素中,锂、钠、钾、铷、铯、钫这些碱金属半径相对很大)。而且他们的最外层只有一个电子参加成键,没有形成8电子的稳定结构,形成的键叫做金属键,比共价键,离子键要弱,所以在固体中原子间相互作用较弱,金属键很容易断裂,所以碱金属的熔点和沸点都较低。
希望对你有帮助哦~~o(∩_∩)o...谢谢你~~~
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












