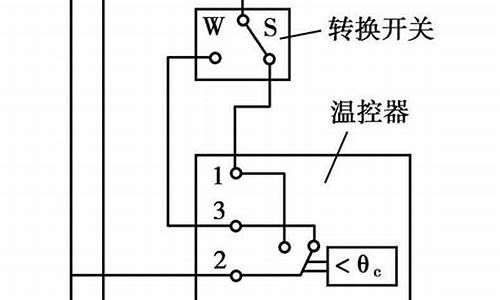
金属单质a与非金属单质s发生如下反应_金属单质和非金属单质反应的例子
1.现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应.(图中有些反应的产物和
2.现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如下反应(图中部分反应的产物和
3.常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,
4.非金属单质A经如下图所示的过程转化为含氧酸D, 已知D为强酸,请回答下列问题:
5.盐和盐的置换反应要遵循哪些规律?大神们帮帮忙
(1)根据A既是金属单质,又能和氧气生成黑色固体;可知我们学过的金属中只有铁在氧气中燃烧生成黑色固体,所以A是铁,那么C一定是四氧化三铁;又铁与氧气、水发生锈蚀而变红,其主要成分是三氧化二铁,可知B是三氧化二铁.
(2)固体D是铁与氯化铜生成的红色固体铜,气体E是金属和酸反应生成的氢气.
故正确答案:
(1)Fe;Fe2O3;Fe3O4;Cu;H2
(2)Fe+CuCl2═FeCl2+Cu;Fe+2HCl═FeCl2+H2↑
现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应.(图中有些反应的产物和
| (1)①H 2 SO 4 ;②酸雨 (2)①N 2 ;NO 2 ? ;②Cu + 4HNO 3 (浓)=Cu(NO 3 ) 2 +2NO 2 ↑+2H 2 O ;属于 |
现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如下反应(图中部分反应的产物和
金属单质A的焰色反应为**,则A是Na,黄绿色气体乙是Cl2,Na和水反应生成NaOH和H2,则甲是H2、C是NaOH,氢气和氯气反应生成HCl,所以丙是HCl,D是盐酸,D和金属B反应生成E,E能被氯气氧化生成F,F和NaOH反应生成红褐色沉淀,则红褐色沉淀是Fe(OH)3,所以F是FeCl3、E是FeCl2、B是Fe,
(1)通过以上分析知,A是Na,C是HCl,故答案为:Na;HCl;
(2)①Na和水反应生成NaOH和H2,离子反应方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
②氯化亚铁和氯气反应生成氯化铁,离子反应方程式为Cl2+2Fe2+=2Fe3++2Cl-,故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
③氯化铁和氢氧化钠反应生成氢氧化铁,离子方程式为Fe3++3OH-═Fe(OH)3↓,故答案为:Fe3++3OH-═Fe(OH)3↓;
(3)铝能溶于氢氧化钠溶液生成偏铝酸钠和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)将Na2O2投入FeCl3溶液中,发生的反应为2Na2O2+2H2O═4NaOH+O2↑,Fe3+与氢氧化钠反应为3OH-+Fe3+═Fe(OH)3↓,立即生成红褐色的Fe(OH)3沉淀,所以看到的现象是:有大量气泡生成,有红褐色沉淀生成,故答案为:生成红褐色沉淀、有无色气体产生;
(5)亚铁离子能被氯气氧化生成铁离子,铁离子能和KSCN溶液反应生成血红色溶液,所以可以用氯水、KSCN检验,氯化亚铁和氢氧化钠溶液反应生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定,易被氧化为红褐色沉淀,故答案为:bd或c.
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,
金属单质A的焰色反应为**,应为Na,与水反应生成的气体甲为H2,C为NaOH,黄绿色气体乙为Cl2,则丙为HCl,D为盐酸,红褐色沉淀G为Fe(OH)3,则B为Fe,F为FeCl3 ,E为FeCl2,
(1)由以上分析可知A为Na,B为Fe,C为NaOH,E为FeCl2,G为Fe(OH)3,乙为Cl2,故答案为:Na;Fe;NaOH;FeCl2;Fe(OH)3;Cl2;
(2)反应①为Na和水的反应,方程式为2Na+2H2O═2NaOH+H2↑,故答案为:2Na+2H2O═2NaOH+H2↑;
(3)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
非金属单质A经如下图所示的过程转化为含氧酸D, 已知D为强酸,请回答下列问题:
| (1)Cl 2 (2分),? K 2 FeO 4 (2分) 取试样少许,滴加3~4滴KSCN溶液,呈血红色(2分)? 8 Al+3Fe 3 O 4 4Al 2 O 3 +9Fe?(2分)? 2Al+2OH — +2H2O=2AlO 2 - +3H2↑(2分) |
| 试题分析:A和B是金属单质,且二者在高温下发生置换反应,则该反应为铝热反应,所以A是Al,E是金属氧化物,F既能溶于强酸M又能溶于强碱N,F是Al 2 O 3 ,B是常见金属,系列转化生成红褐色沉淀Y为Fe(OH) 3 ,所以B是Fe,E是金属氧化物,所以D是O 2 ,E是Fe 3 O 4 ,铁和非金属单质反应生成X,X能和强碱N反应生成红褐色沉淀Fe(OH) 3 ,氢氧化铁和碱、C反应生成Z,所以Z中含有铁元素,Z的摩尔质量为198g?mol-1,且其中各元素的质量比为:钾:铁:氧=39:28:32,钾、铁、氧的物质的量之比="39" 39 :28 56 :32 16 =2:1:4,所以其化学式为K 2 FeO 4 ,根据元素守恒知,强碱N为KOH,氢氧化铁能被C单质氧化,且C是气体,B和C反应生成铁盐,则C是Cl 2 ,X是FeCl 3 ,H为KAlO 2 ,H和M反应生成J,J能溶于强酸和强碱,则J为Al(OH) 3 , (1)通过以上分析知,C是氯气,Z是高铁酸钾,其化学式分别为:Cl 2 、K 2 FeO 4 , (2)X是氯化铁,铁离子和硫氰根离子反应生成血红色溶液,所以可以用硫氰化钾溶液检验铁离子,其操作方法是:取试样少许,滴加3~4滴KSCN溶液,呈血红色, (3)高温下,四氧化三铁和铝发生置换反应生成氧化铝和铁,反应方程式为:8 Al+3Fe 3 O 4 ?4Al 2 O 3 +9Fe, (4)A是铝,N是氢氧化钾,铝和氢氧化钾溶液反应生成偏铝酸钾和氢气,离子反应方程式为:2Al+2OH - +2H 2 O=2AlO 2 - +3H 2 ↑, |
盐和盐的置换反应要遵循哪些规律?大神们帮帮忙
S、SO2、SO3、H2SO4
(1):N2、NO、NO2、HNO3
(2):4NH3 + 5O2 = 4NO + 6H2O
很高兴为您解答 ~~
满意请纳(手机版点“满意”即可)
置换反应总结 在化学中,有个反应叫置换反应,是一种单质跟一种化合物生成另一种单质和另一种化合物的化学反应。置换反应类型在解答无机框图推断试题过程中具有其特殊的功用,以其特殊的形式往往成为解题的突破口。但由于学生在学习过程中,不善于积累,缺乏总结,置换反应的实例在头脑中没贮存多少,因而对这类试题总是感到束手无策。现将置换反应的实例类型归纳如下: 一、金属置换出金属 Zn+CuSO4=ZnSO4+Cu 说明:还原性强的把还原性弱的置换出来 2Al+Fe2O3====Al2O3+2Fe 发生反应,说明Al元素的的还原性比Fe元素的还原性强。同理Al与V2O5、CrO3等金属氧化物组成的混合物,也称为铝热剂。发生类似反应,说明Al比V、Cr等金属还原性强。 工业上制取金属钾的原理:Na+KCl===NaCl+K↑。这个反应发生,不能说明Na的还原性比K强。其原因是,在熔融状态下,金属钾已经变为蒸汽,从化学平衡的角度来说,及时将生成的钾蒸汽从平衡体系中抽走,平衡向正反应方向进行。所以反应能进行到底。 反应Mg+2RbCl=MgCl2+2Rb↑的原理相类似。 过量的Zn与FeCl3溶液发生反应:3Zn+2FeCl3=3ZnCl2+2Fe 此反应相当于Zn+FeCl3=ZnCl2+FeCl2、Zn+FeCl2=ZnCl2+Fe两个方程式叠加的结果。 二、金属置换出非金属 2Na+2H2O=2NaOH+H2↑ 2Na+2CH3CH2OH=2CH3CH2ONa+H2↑ Fe+2HCl=FeCl2+H2↑ Mg+2HCl=MgCl2+H2 点燃 2Al+6HCl=2AlCl3+3H2 高温 2Mg+CO2====2MgO+C 3Fe+4H2O(g)===Fe3O4+4H2 三、非金属置换出金属(在干态条件下反应) H2+CuO===Cu+H2O;此反应不能说明H2的还原性比Cu强。因为发生反应的条件比较特殊,在干态高温条件下,生成的H2O脱离了反应体系,从而使反应能进行到底。同理炼铁发生反应 3C+2Fe2O3==4Fe+3CO2 四、非金属置换出非金属 卤素间的置换反应: Cl2+2NaBr=2NaCl+Br2;说明Cl2的氧化性比Br2的氧化性强 Br2+2KI=2KBr+I2;说明Br2的氧化性比I2的氧化性强 2F2+2H2O=4HF+O2;说明F2的氧化性比O2的氧化性强 2H2S+O2=2H2O+S↓;说明O2的氧化性比S的氧化性强 2H2S+Cl2=2HCl+S↓;说明Cl2的氧化性比S的氧化性强 C+H2O==CO+H2 2C+SiO2===Si+2CO(此反应产物一定是CO,而不是CO2) 也有按其它标准将置换反应进行分类总结,如: 一、按元素的性质划分,金属与非金属单质间的置换。 1、金属置单质换金属单质 2Al+Fe2O3 =Al2O3+2Fe (铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换) Fe+CuSO4 =FeSO4+Cu 2、金属单质置换非金属单质 2Na+2H2O =2NaOH+H2 2Mg+CO2 =2MgO+C 3Fe+4H2O(g)= Fe3O4+4H2 3、非金属单质置换金属单质 H2+CuO= Cu+H2O C+FeO= Fe+CO Si+2FeO= 2Fe+SiO2 4、非金属单质置换非金属单质 2F2+2H2O= 4HF+O2 2C+SiO2 =Si+2CO C+H2O =CO+H2 2H2+SiCl4 =Si+4HCl 二、按元素在周期表的位置划分,同族元素单质间的置换与不同族元素单质间的置换。 1、同主族元素单质间的置换 Na+KCl= NaCl+K 2Na+2H2O= 2NaOH+H2 2H2S+O2 =2S+2H2O 2C+SiO2= Si+2CO Cl2+2HI=2HCl+I2 F2+2HCl=2HF+Cl2 2、不同主族元素单质间的置换 Mg+2HCl= MgCl2+H2 2Mg+CO2=2MgO+C 2Al+6HCl= 2AlCl3+3H2 2F2+2H2O= 4HF+O2 C+H2O= CO+H2 2H2+SiCl4= Si+4HCl H2S+Cl2 =S+2HCl 3Cl2+8NH3=6NH4Cl+N2 4NH3+3O2=2N2+6H2O 3、主族元素单质置换副族元素的单质 H2+CuO= Cu+H2O 2Al+Fe2O3=Al2O3+2Fe C+CuO=Cu+CO 2Al+3Hg2+ =2Al3++3Hg Na+TiCl4 =4NaCl+Ti 4、副族元素的单质置换主族元素单质 3Fe+4H2O(g)= Fe3O4+4H2 Zn+2H+ =Zn2++H2 5、副族元素的单质置换副族元素的单质 Fe+CuSO4 =FeSO4+Cu 三、按物质类别划分,单质与氧化物间的置换和单质与非氧化物间的置换。 1、单质与氧化物发生置换反应 2Na+2H2O=2NaOH+H2 2Mg+CO2 =2MgO+C 3Fe+4H2O(g)= Fe3O4+4H2 H2+CuO=Cu+H2O C+FeO=Fe+CO 2F2+2H2O=4HF+O2 2C+SiO2=Si+2CO 2Al+Fe2O3=Al2O3+2Fe C+H2O=CO+H2 2H2+SiCl4=Si+4HCl Si+2FeO=2Fe+SiO2 3H2+Fe2O3=2Fe+3H2O 2、单质与非氧化物发生置换反应 2H2+SiCl4=Si+4HCl H2S+Cl2=S+2HCl 3Cl2+8NH3=6NH4Cl+N2 4NH3+3O2=2N2+6H2O 相关习题 1、中学化学常见物质间的转化关系,推断并完成下列空白: ⑴当A为两种非金属元素所组成的化合物时,化合物A的电子式:_________化合物B的电子式:___________单质乙的同素异形体的化学式:__________________________________ 反应①的化学方程式:__________________________________________________________。 ⑵当A为金属元素与非金属元素所组成的化合物时,化合物B的化学式为______________ 单质甲少量时反应①的离子方程式为______________________________________________。 单质甲过量时反应①的离子方程式为______________________________________________。 参考答案:⑴CO2、CO、O3、CO2+2Mg=2MgO+C;⑵FeBr3、2Fe2++Cl2=2Fe3++2Cl-;2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2; 2、已知A、B为单质,甲、乙为化合物,且A与甲的水溶液能发生如下反应:A+甲=B+乙,则下列判断错误的是( ) (A)若A是金属,则B可能是金属,也可能是非金属 (B)若A是非金属,则B可能是金属,也可能是非金属 (C)若甲是酸,则A可能是金属,也可能是非金属 (D)若甲是盐,则A可能是金属,也可能是非金属
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。