非金属单质与其化合物的转化_非金属单质与金属化合物反应
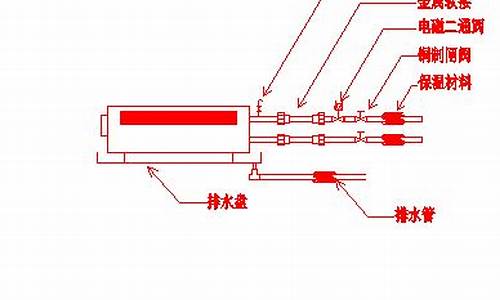
1.已知:A、B、C、D均为中学化学常见物质,其中A为非金属单质.它们的转化关系如图1所示.(1)若A常温下为
2.B C D E是非金属单质,在常温常压下是气体,G的焰色范围为**,化合物I和J通常状况下呈气态,反应1是化工
3.如何比较元素非金属性的强弱
4.如图是初中化学中常见的物质间的转化关系,其中甲、丙均为非金属单质,A、B、E、乙和丁均为化合物,E和乙
5.初中化学中常见物质间的转换关系其中甲乙丙均为非金属单质;ABE和丁均为化合物;B和E为能产生温室效应气体
6.物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.(1)若X、W是常见的非金属单质,该

依据转化关系中的反应特征和条件C+D=I的反应条件是光照,推断为氢气和氯气的反应,I+J=铵盐H,说明I是HCl,J是NH3,D为H2,C为Cl2,E为N2,化合物G的焰色反应为**说明含钠元素,G+I=CO2,证明G为碳酸盐;B是非金属单质是F和二氧化碳反应生成的,推断F为Na2O2,B为O2,A为Na,
(1)由以上分子可知H的化学式为NH4Cl,F为Na2O2,为离子化合物,电子式为,故答案为:NH4Cl;;
(2)F为Na2O2,F和CO2的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,G为碳酸盐溶液,与等物质的量的盐酸反应的离子方程式为CO32-+H+=HCO3-,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;CO32-+H+=HCO3-;
(3)A(Na)与B(O2) 在加热条件下反应的主要现象是:剧烈反应,火焰为**,生成淡**的固体,检验H(NH4Cl)中阳离子(NH4+)的方法为:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为:剧烈反应,火焰为**,生成淡**的固体;取少量H?样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
已知:A、B、C、D均为中学化学常见物质,其中A为非金属单质.它们的转化关系如图1所示.(1)若A常温下为
| (1)①H 2 SO 4 ②酸雨? (2)①N 2 ? NO 2 ?②Cu+4HNO 3 (浓)=Cu(NO 3 ) 2 +2H 2 O+2NO 2 |
| 试题分析:根据元素化合物知识分析,非金属单质可以实现上述转化的分别有C、S、N 2 , D为强酸,则不会是碳单质的转化;(1)①B是能使品红溶液褪色的被有刺激性气味的无色气体,B为SO 2 .所以据此推断C为SO 3 、D为H 2 SO 4 ;②SO 2 被雨水吸收后生成H 2 SO 3 和H 2 SO 4 ,即形成酸雨;(2)①A在常温下为气体,C是红棕色气体为NO 2 ,A为N 2 ;②据①可知D为硝酸,浓硝酸与铜反应生成NO 2 ,答案为:Cu+4HNO 3 (浓)=Cu(NO 3 ) 2 +2H 2 O+2NO 2 ↑. |
B C D E是非金属单质,在常温常压下是气体,G的焰色范围为**,化合物I和J通常状况下呈气态,反应1是化工
(1)若A常温下为固体,A氧化得到B、B氧化得到C,C与水反应得到D为酸,D与Cu反应得到B,可推知,A为S、B为SO2、C为SO3、D为H2SO4,则:
①D→B是Cu与浓硫酸反应生成硫酸铜、二氧化硫与水,反应化学方程式为:Cu+2H2SO4(浓)
| ||
| ? |
故答案为:Cu+2H2SO4(浓)
| ||
| ? |
②反应过程中浓硫酸逐渐变为稀硫酸,稀硫酸与铜不反应,硫酸一定有剩余,故生成的SO2一定小于0.5mol,
故答案为:反应过程中浓硫酸逐渐变为稀硫酸,稀硫酸与铜不反应,硫酸一定有剩余,故生成的SO2一定小于0.5mol;
③SO2造成的环境问题主要是导致酸雨,工业上为减小SO2造成的污染,常用碱进行回收利用,回收B后再利用生成的一种盐为硫酸钠,化学式为Na2SO4,
故答案为:酸雨;硫酸钠、Na2SO4;
(2)若A常温下为气体单质,A连续氧化得到C,氮元素单质化合物符合转化关系,A为N2、B为NO、C为NO2、D为HNO3,则:
①反应D→B是Cu与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②当有1.5mol?Cu参与反应时,由方程式可知,生成NO的物质的量=1.5mol×
| 2 |
| 3 |
故答案为:1mol;
③装置Ⅰ中圆底烧瓶中有空气,空气中的氧气会与NO反应生成NO2,出现红棕色,不能证明产生的是NO,装置Ⅱ中没有空气,可以证明,
故答案为:Ⅱ;圆底烧瓶中有空气,空气中的氧气会与NO反应生成NO2,出现红棕色,不能证明产生的是NO.
如何比较元素非金属性的强弱
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,
地址是:://.sy11z.edu.cn/v2009/images/upload/2009631557167698.jpg
已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为**,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
据此推断A:Na2O B。O2 C。Cl2 D。H2 E。N2
F。Na2O2 G。Na2CO3 I。HCl J。NH3
如图是初中化学中常见的物质间的转化关系,其中甲、丙均为非金属单质,A、B、E、乙和丁均为化合物,E和乙
比较方法如下:
一、从元素原子结构判断:
1、比较元素非金属性的强弱,其实质是比较元素原子得到电子的难易程度,越易得电子,非金属性越强。当最外层电子数相同时,电子层数越多,原子半径越大,越不易得到电子,非金属性越弱。
二、从元素单质及其化合物的相关性质判断:
1、单质越易跟氢气化合,生成的氢化物也就越稳定,氢化物的还原性也就越弱,其非金属性也就越强。
2、最高价氧化物的水化物的酸性越强,其非金属性越强。如硫酸的酸性强于磷酸,说明硫的非金属性比磷强。
3、非金属单质间的置换反应。
4、元素的原子对应阴离子的还原性越强,元素的非金属性越弱。如硫离子的还原性比氯离子强,说明氯的非金属性比硫强。
扩展资料
常见非金属性的比较规律:
1、由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。(反例:氮原子氧化性弱于氯原子)
2、由单质和水生成酸的反应程度判断:反应越剧烈,非金属性越强。
3、由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。(反例:甲烷比氨稳定)
4、由和氢气化合的难易程度判断:化合越容易,非金属性越强。
5、由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属性越强。(反例:硝酸的酸性弱于硫酸和高氯酸,硒酸的酸性强于硫酸)
值得注意的是:氟元素没有正价态,氧目前无最高正价,硝酸则因分子内氢键导致酸性较弱,所以最高价氧化物对应水合物的酸性最强的是高氯酸,而不是非金属性高于氯的氮氧氟。
初中化学中常见物质间的转换关系其中甲乙丙均为非金属单质;ABE和丁均为化合物;B和E为能产生温室效应气体
(1)首先由甲、乙、E三种物质为可燃物,丙和三种具有可燃性的物质甲、E、乙发生反应,可推断单质丙是氧气;具有可燃性的单质甲为碳或氢气,两种物质都具有还原性,因此与甲具有相似化学性质的化合物乙可判断为一氧化碳,则一氧化碳燃烧生成的B为二氧化碳,那么单质甲燃烧生成的A则不为再为二氧化碳,则可推测A为水,因此单质甲就为氢气;
综合以上分析,甲为氢气H2、乙为一氧化碳CO;
(2)根据(1)的推到可知丙是氧气,根据化合物丙燃烧生成二氧化碳和水,可猜测丙是甲烷(或酒精),甲烷(或酒精)和氧气在点燃的条件下生成水和二氧化碳,反应的化学方程式为CH4+2O2
| ||
| ? |
(3)物质A为水H2O,由D和A是组成元素相同的化合物,则物质D应为过氧化氢H2O2,D生成A和丙的化学反应方程式为2H2O2
| ||
| ? |
故答案为:(1)H2;CO;(2)CH4+2O2
| ||
| ? |
| ||
| ? |
物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.(1)若X、W是常见的非金属单质,该
请将题目补充完整,以便推断,谢谢~
没有图表示压力好大~~
推断出 甲为H2 ,乙为Cl2 ,丙为O2,A为H2O,B为CO2,E为CH4
(1)反应方程式如下
H2+Cl2===点燃====2HCl
(2)CH4+2O2==点燃===2H2O+CO2
(3)H2O2===MnO2===H2O+O2 (气体符号) 丁为二氧化锰
根据这些条件,我只能填上这么多
具体思路如下:
初中有催化剂参加的反应,最经典的莫过于H2O2的分解了,因此我首先推断出D是H2O2
从而得出A是H2O,D是MnO2,丙当然就是O2
丙和E反应,甲烷要和单质反应,我当然是想到甲烷在氧气中点燃,生成水和二氧化碳。
同时也符合B、E是温室气体的要求。
能否提供一些和甲、乙有关的线索~多谢
由于没有图。根据中学学的单质,我只能推测一下
甲乙可以是H2 和 Cl2
反应条件为点燃 H2+Cl2===点燃====2HCl
| (1)该反应在工业上可用来生产水煤气,应为C和H 2 O的反应,则X为C,Y为H 2 O,W为H 2 ,Z为CO, ①生产水煤气的反应方程式为C+H 2 O
②C、CO和H 2 常用于冶炼金属的还原剂,共3种,故答案为:c; (2)Y是红棕色固体,常用作红色油漆和涂料,应为Fe 2 O 3 ,则X与Y的反应应为铝热反应,X为Al,W为Fe,Z为Al 2 O 3 , ①该反应为铝热反应,反应的方程式为Fe 2 O 3 +2Al
②n(H 2 )=
|
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。