某金属单质_某金属单质和浓硝酸反应时,生成NO2的化学方程式的配平
1.金属单质和盐反应
2.某同学探究金属单质的活泼性时发现:X、Y都能与稀硫酸反应放出氢气而Z不能;Y能在X的盐溶液中置换出X.则
3.已知一些金属单质的发现、使用与其金属活动性存在着某种必然联系,金属越活泼,越不容易被发现和使用.据
4.某两种金属单质的混合物4g与足量的氯气反应,生成氯化物质量为Wg,并且(W-4)为7.1g,则两种金属是?
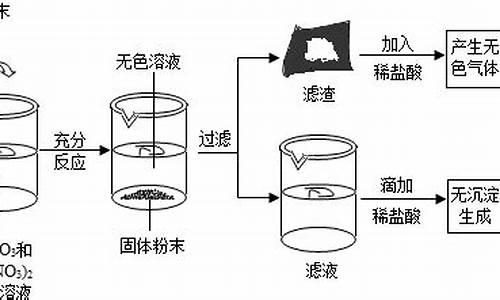
解析:
22.
(1)C:Na2CO3、D:CO2、E:NaOH
(2)①2Na + 2H2O ―→ 2NaOH + H2↑
②2Na2O2 + 2CO2 ―→ 2Na2CO3 + O2
③Cl2 + 2NaOH ―→ NaCl + NaClO + H2O
23.设生成的NaOH质量为 x g,O2质量为 y g,则有:
2Na2O2 + 2H2O ―→ 4NaOH + O2↑
78×2 40×4 32
7.8 g x g y g
解得:x = 8 g,y = 1.6 g
所以NaOH物质的量 = 8 g / 40 g/mol = 0.2 mol
标况下O2体积 =( 1.6 g / 32 g/mol)× 22.4 L/mol = 1.12 L
金属单质和盐反应
| B |
| 试题分析:X、Y都能与稀硫酸反应放出氢气而Z不能;说明XY的活泼性强于Z,Y能在X的盐溶液中置换出X。说明金属Y的活泼性强于X,则它们的金属活动顺序为Y>X>(H)>Z,所以答案选择B |
某同学探究金属单质的活泼性时发现:X、Y都能与稀硫酸反应放出氢气而Z不能;Y能在X的盐溶液中置换出X.则
金属单质和盐之间可以发生不同的反应。以下是一些典型的金属单质和盐反应的示例:
1、金属单质和盐的置换反应:金属单质可以取代盐中的金属离子,形成新的盐和游离的金属。
例如,锌和盐酸反应会生成氯化锌和氢气的挥发。Zn(s)+2HCl(aq)→ZnCl2(aq)+H2(g)
2、金属单质和盐的氧化还原反应:某些金属单质可以氧化盐中的金属离子,同时自身被还原。这类反应包括金属的腐蚀或金属离子的还原。
例如,铁可以还原铜离子,生成铁离子和铜单质。Fe(s)+CuSO4(aq)→FeSO4(aq)+Cu(s)
3、其他反应:金属单质和盐还可以通过复合反应或双替换反应发生其他类型的化学变化。这些反应的结果可能根据反应条件和参与的物质而有所不同。
需要注意的是,不是所有金属单质和盐都会发生反应。反应的发生与金属的电位、盐中金属离子的活性以及反应条件等因素有关。在具体实验或化学反应中,应根据具体情况进行考虑和实施。
当金属单质和盐发生反应时,可能会观察到以下现象:
1、气体释放:在某些反应中,金属单质与盐溶液反应会产生气体。例如,金属与酸类盐反应会释放出氢气。
2、溶液变色:反应可能导致溶液的颜色发生变化,这可能是由于盐中的金属离子被金属单质取代或还原导致的。
3、沉淀生成:在一些反应中,会形成可见的沉淀物,这是由于反应生成的新盐的溶解度较低而导致的。
4、金属溶解:在一些情况下,金属单质可以溶解于盐溶液中形成金属离子,并且观察不到明显的反应产物。
需要注意的是,金属单质和盐反应的具体现象可能取决于所选用的金属和盐的类型,反应条件(如浓度、温度等)以及反应过程中的其他因素。因此,在具体实验或化学反应中,应根据具体情况进行观察和分析。
已知一些金属单质的发现、使用与其金属活动性存在着某种必然联系,金属越活泼,越不容易被发现和使用.据
| “X、Y都能与稀硫酸反应放出氢气而Z不能”,说明金属X、Y在金属活动性顺序表中处于H之前,属于活泼金属,而金属Z处于H之后,属不活泼金属; “Y能在X的盐溶液中置换出X”,说明金属Y的活动性大于金属X. 因此活动性由强到弱的顺序为:Y>X>H>Z. 故选B. |
某两种金属单质的混合物4g与足量的氯气反应,生成氯化物质量为Wg,并且(W-4)为7.1g,则两种金属是?
在金属活动性顺序中,铝>锌>铁>铜,由于越活泼的金属开发利用的时间越晚,所以人类开发利用下列金属的时间由先到后的顺序是铜、铁、锌、铝.
所以开发利用最早的是铜;
故选:A.
设金属为+2价,则说明4g金属能与7.1g氯气完全反应。氯气0.1mol,此时理论上要消耗0.1mol金属,混合金属平均摩尔质量为4/0.1=40,排除A和C.
对于B选项。设全部是钠,则有0.20mol钠,质量0.2*23=4.6g;设全部是锌,锌的质量0.1*65=6.5g,也不符合题意,排除此项。
最后对于D。设全部是铁,0.1*56=5.6g;设全部是铝,0.1*2/3*23=0.18g,符合要求,故选D.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












