金属单质有哪些_金属单质有哪些?
1.常见的金属单质有哪些
2.下列哪些属于金属单质?哪些属于非金属单质?
3.物质的分类有哪些
4.金属单质有哪些
一)、固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡**固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、**溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
常见的金属单质有哪些
钾(K)、钙Ca、纳Na、镁Mg、铝Al、锌Zn、铁Fe、锡Sn、铅Pb、氢H、铜Cu、汞Hg、银Ag、铂Pt、金Au
但是不会系统的学习金属单质的性质的,是会涉及到一些比较简单的反应,不会涉及到氧化还原反应,所以只是大致的了解一下就可以了。
望纳,谢谢!
下列哪些属于金属单质?哪些属于非金属单质?
问题一:怎么满足自己的食欲而又不发胖呢! 多餐少食是最科学的减肥方法!
问题二:常见的金属单质有哪些 常见的金属单质有:铁、铜、银、金、铝等等.
问题三:初中化学中常见的金属单质有哪些 钠(Na)
银白色金属,质软,化学性质活泼,与水发生剧烈反应,在氧气中燃烧生成过氧化钠
铁(Fe)
铁在氧气中燃烧生成Fe3O4,和酸反应生成盐和H2
镁(Mg)
剧烈燃烧发出白光,和酸剧烈反应产生H2,可以在CO2中燃烧生成MgO和碳
锌(Zn)
实验室制取氢气的原料,2Zn+2HCl==2ZnCl+H2
金属的活泼性顺序:
K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)>Cu>Hg>Ag>Pt>Au
越往前的金属活泼性越强,越易失去电子,金属性越强
问题四:初中化学中常见的金属单质有哪些 开课啦-互联网名师辅导,建议:初中化学中常见的金属单质按照金属活动顺序由大到小排列
钾 钙 纳 镁 铝 锌 铁 铜 银
物质的分类有哪些
N2、Fe、C是单质;N2.C也是非金属单质;氧化镁、二氧化碳、五氧化二磷、水是氧化物;氯化钾、纯碱是盐;烧碱是碱;<15>是有机物;<12>是混合物;<14>胶体;泥水是浊液!
以上仅供参考!
金属单质有哪些
一.纯净物
1.单质 :金属单质和非金属单质.
金属单质主要有:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、Cu、Hg、Ag、Au等
非金属单质主要有:C、S、P、Si、O2、N2、H2、Cl2、He、Ne、Ar
2.化合物:有机物:烃、烃(烃的衍生物)、营养物质
无机物:氧化物、氢化物、酸、碱和盐等
烃:烷烃(甲烷),烯烃(乙烯)
营养物质:葡萄糖、蛋白质、脂质[1]
氧化物:由氧和另一种元素组成的纯净物(无机物)
酸性氧化物:SO2、CO2、P2O5、Mn2O7等
碱性氧化物:MgO、CaO、Na2O(一定是金属氧化物)等
氧化物:Al2O3、ZnO等
不成盐氧化物:CO、NO等
过氧化物:Na2O2、H2O2等
酸:指电离时产生的阳离子全部都是氢离子的化合物
含氧酸:HNO3等
无氧酸:HCl等
一元酸:HCl、HNO3等
二元酸:H2CO3、H2SO4、H2S等
多元酸:H3PO4等
碱:指电离时产生的阴离子全部都是氢氧根离子的化合物
强碱:NaOH等
弱碱:Fe(OH)3、NH3·H2O等
可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O
不溶性碱:Mg(OH)2、Cu(OH)2、Fe(OH)3等
盐:指电离时生成金属阳离子(或NH4)和酸根离子的化合物
正盐:Na2CO3、NaCl、BaSO4等
酸式盐:NaHCO3等
碱式盐:Cu2(OH)2CO3等
复盐:KAl(SO4)2·12H2O
二.混合物:溶液、胶体、悬浊液、乳浊液等
金属单质有:铁、铜、银、金、铝等。
金属单质是由同种金属元素形成的纯净物。金属单质是单质的一种类别。一般来说,单质的性质与其元素的性质密切相关。比如,很多金属的金属性都很明显,那么它们的单质还原性就很强。
具有金属通性的元素。金属元素种类高达八十余种,性质相似,主要表现为还原性,有光泽,导电性与导热性良好,质硬,有延展性,常温下一般是固体。
常见的金属单质有:铁、铜、银、金、铝等。重金属,如铜、锌、铅、镍等;轻金属,如钠、钙、镁、铝等;贵金属,如金、银、铂、铱等;稀有金属,如锗、铍、镧、铀等。
金属划分依据
根据金属在标准氢电极下与非氧化性酸的反应中的失电子能力,可以将金属分为活性金属和钝性金属。活性金属指的是那些能与酸反应并放出氢气的金属,如钾、钠、钙、镁等。
这些金属在化学反应中易失去电子,表现出较高的活泼性。而钝性金属则是指那些不能与酸反应产生氢气的金属,如金、银、铂等。这些金属在化学反应中不易失去电子,因此表现出较低的化学活性。
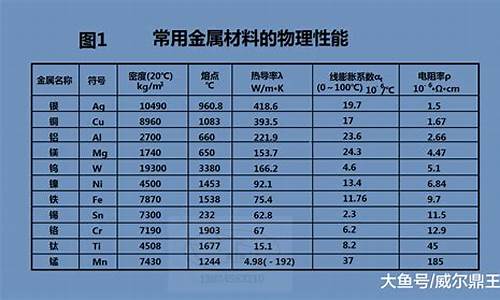
根据金属的导电性能,可以将金属分为良导体和不良导体。良导体是指电阻率较小的金属,如银、铜、铝等,它们的导电性能较好,常用于制作电线、电路板等。不良导体是指电阻率较大的金属,如铁、镍、钨等,它们的导电性能较差,常用于制作热敏电阻、电热器等。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。