金属单质和非金属单质_金属单质和非金属单质反应化学方程式
1.金属与非金属单质发生反应被氧化的一定是金属吗
2.化学式书写时,金属单质是不是一直放在非金属单质的
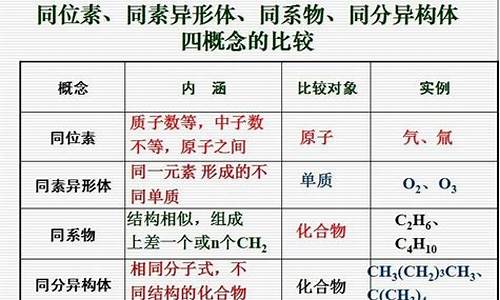
单质分为金属单质、非金属单质、稀有气体单质三大类。
单质是由同种元素组成的纯净物。元素以单质形式存在时的状态为元素的游离态。
详情如下:
一般来说,单质的性质与其元素的性质密切相关。如很多金属的金属性都很强,那么它们的单质还原性就很强。不同种类元素的单质,其性质差异在结构上反映得最为突出。与单质相对,由多种元素组成的纯净物是化合物。
非金属单质一般以共价键结合成分子。常温下,很多非金属单质都以双原子分子形式存在,如氢气、氧气等。一些元素还可形成多原子的分子,如臭氧(O3)、足球烯(C60)等。能形成原子晶体的单质在常温下都是固态,而且较硬,如钻石等。
稀有气体的价电子层是满的,所以它们不需要结合成分子以使自己更稳定,因此它们在常温常压下都是单原子分子的气体。上述物质中都没有可自由移动的电子,因此它们都是电的不良导体。例外的是石墨,它具有特殊的层状结构,质地松软,且可以导电。
金属与非金属单质发生反应被氧化的一定是金属吗
1.金属单质和非金属单质
2Na+2H2O=H2(气体)+2NaOH.
2 金属和金属
Fe+CuSO4=Cu+FeSO4
3.非金属和金属
H2+CuO=加热=Cu+H2O
4,非金属之间
Cl2+2NaBr=2NaCl+Br2
不懂问
化学式书写时,金属单质是不是一直放在非金属单质的
金属单质和非金属单质发生氧化还原反应,只有非金属才能作为氧化剂,金属作为还原剂,那么氧化的物质一定是金属。
氧化-还原反应是化学反应前后,元素的氧化数有变化的一类反应。氧化还原反应的实质是电子的得失或共用电子对的偏移。 氧化还原反应是化学反应中的三大基本反应之一(另外两个为(路易斯)酸碱反应与自由基反应) 。自然界中的燃烧、呼吸作用、光合作用,生产生活中的化学电池,金属冶炼,火箭发射等等都与氧化还原反应息息相关。研究氧化还原反应,对人类的进步具有极其重要的意义。
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应; 氧化数降低的反应,称为还原反应。 氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。反应中,发生氧化反应的物质,称为还原剂,生成氧化产物;发生还原反应的物质,称为氧化剂,生成还原产物。氧化产物具有氧化性,但弱于氧化剂;还原产物具有还原性,但弱于还原剂。
一个化学反应,是否属于氧化还原反应,可以根据反应是否有氧化数的升降,或者是否有电子得失与转移判断。如果这两者有冲突,则以前者为准。
有机化学中氧化还原反应的判定通常以碳的氧化数是否发生变化为依据 :碳的氧化数上升,则此反应为氧化反应;碳的氧化数下降,则此反应为还原反应。由于在绝大多数有机物中,氢总呈现正价态,氧总呈现负价态,因此一般又将有机物得氢失氧的反应称为还原反应,得氧失氢的反应称为氧化反应。根据作为氧化剂的元素和作为还原剂的元素的来源,氧化还原反应可以分成两种类型:分子间氧化还原反应、分子内氧化还原反应。
氧化还原反应中,存在以下一般规律:
1、强弱律:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
2、价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
3、转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态 。
4、优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。
5、守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
1、书写化学式时,金属?单质?和非金属?单质?没有固定的先后顺序。
2、但在书写由金属元素和非金属元素组成的?化合物的化学式?时,一般是金属元素?的符号在前;非金属元素?的符号在后。如:
硫化亚铁 —— FeS ?.
氧化镁 —— MgO ?.
氯化银 —— AgCl ? .
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。