非金属单质定义_非金属单质定义是什么
1.非金属单质是什么晶体
2.非金属单质的通性
单质必须是由同种元素组成的纯净物,混合物不可能是单质.元素在单质中存在时称为元素的游离态.
一般来说,单质的性质与其元素的性质密切相关.比如,很多金属的金属性都很明显,那么它们的单质还原性就很强.不同种类元素的单质,其性质差异在结构上反映得最为突出.
与单质相对,由多种元素组成的纯净物叫做化合物.
混合物是由两种或多种物质混合而成的(或由不同种分子构成的).(.无固定组成和性质,而其中的每种单质或化合物都保留着各自原有的性质.混合物可以用物理方法将所含物质加以分离.
混合物是由两种及两种以上纯物质(元素或化合物)没有经化学合成而组成的物质.
混合物如:含有氧、氮、稀有气体、二氧化碳等多种气体的空气,含有各种有机物的石油(原油)、天然水、溶液、泥水、牛奶、合金、石灰燃料(煤、石油、天然气)、石灰石……
单质必须是由同种元素组成的纯净物,混合物不可能是单质.元素在单质中存在时称为元素的游离态.
纯净物
定义:由单一物质组成的物质称为纯净物.
包括:纯净物包括了单质和化合物
所以纯净物不一定是单质,但单质一定是纯净物
例如说O2是单质,也是纯净物,而CO2不是单质,但是纯净物
单质是由一种元素组成的物质 如O2 N2 FE
单质的定义是由一类原子组成的物质
不能是化合物
金属单质就是由金属原子组成的单质:Hg汞
非金属单质就是由非金属原子组成的单质:S单体硫 或 Si硅
非金属单质是什么晶体
金属单质和非金属单质反应化学方程式为4Na+O2=2Na2O、2Na+Cl2=2NaCl。
一、金属单质
金属单质是由同一种金属元素组成的无机化合物。在自然界中,金属元素通常以单质的形式存在,以纯净金属的形式出现。金属单质具有一些特征性质,如良好的导电性、热传导性、延展性和可塑性等。
金属单质的原子结构具有特殊的电子排布方式。金属元素的外层电子较少,通常在形成金属晶格时,这些外层电子相互共享或移动形成电子海,使金属具有良好的导电性和热传导性。
二、非金属单质
非金属单质是由非金属元素组成的无机化合物。与金属不同,非金属单质通常以分子的形式存在,而不是以晶格结构存在。非金属元素通常是在自然界中以单质的形式存在,如氧气(O?)、氮气(N?)、氯气(Cl?)等。
它们的原子结构包含外层电子较多,并且倾向于吸引、接受或共享电子。
化学方程式的起源与重要作用
一、化学方程式的起源
在十八世纪末和十九世纪初,一些著名的化学家如路易斯·迈尔、安东尼奥·拉瓦锡和约翰·道尔顿等人,进一步完善了化学方程式的表示方法。他们提出了许多关于质量守恒、化学反应机理和元素比例的理论。
到了十九世纪中期,奥古斯特·科代勒和阿道夫·沙克尔等化学家开始使用现代化学符号来表示化学方程式中的化学物质和反应条件。他们还开发了一套规则和约定来编写和解释化学方程式。
二、化学方程式的重要作用
1、描述化学反应
化学方程式是描述化学反应的主要方法之一。它们清晰地表明了反应物和生成物之间的化学变化和物质转化。通过化学方程式可以了解反应的组成、比例、反应条件等重要信息。
2、质量守恒定律
化学方程式中的反应物和生成物之间的质量总量保持不变,符合质量守恒定律。这一定律是化学方程式的基础,使得化学方程式成为实验结果符合理论预期的重要工具。
3、反应机理研究
化学方程式揭示了化学反应的基本过程和机理,帮助科学家深入研究反应的速率、中间物种以及反应路径。
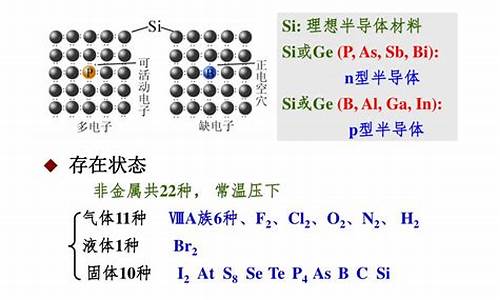
非金属单质的通性
惰性气体元素的晶体 惰性气体在低温下形成的晶体为A1(面心立方)型或A3(六方密堆)型结构。由于惰性气体原子外层为满电子构型,它们之间并不形成化学键,低温时形成的晶体是靠微弱的没有方向性的范德华力直接凝聚成最紧密堆积的A1型或A3型分子晶体。
其它非金属元素单质的晶体结构 —休谟-偌瑟瑞(Hume-Rothery)规则 如果某非金属元素的原子能以单键与其它原子共价结合形成单质晶体,则每个原子周围共价单键的数目为8减去元素所在周期表的族数(m),即共价单键数目为8-m,亦称为8-m规则。 对于第VII族元素,每个原子周围共价单键个数为8-71,因此,其晶体结构是两个原子先以单键共价结合成双原子分子,双原子分子之间再通过范德华力结合形成分子晶体,如图1-11 。 对于第VI族元素,单键个数为8-62,故其结构是共价结合的无限链状分子或有限环状分子,链或环之间由通过范德华力结合形成晶体,如图1-12 。 对于第V族元素,单键个数为8-53,每个原子周围有3个单键(或原子),其结构是原子之间首先共价结合形成无限层状单元,层状单元之间借助范德华力结合形成晶体,如图1-13 。 对于第IV族元素,单键个数为8-44,每个原子周围有4个单键(或原子)。其中C、Si、Ge皆为金刚石结构,由四面体以共顶方式共价结合形成三维空间结构..
1、非金属性
非金属元素的通性,它指某种非金属元素的原子得到电子的能力。某元素原子非金属性越强,即其得电子能力越强。由元素周期表上看,靠右的元素非金属性比靠左的元素非金属性要强,靠上的元素非金属性比靠下的元素非金属性要强。对于元素的单质,非金属性体现在单质的氧化性上。
2、物理性质
非金属单质大多是分子晶体,少部分为原子晶体和过渡型的层状晶体。
3、氧化性还原性
元素的金属性越强,它的单质还原性越强,而它阳离子的氧化性越弱。
扩展资料
非金属元素种类
非金属元素是元素的一大类,在所有的一百多种化学元素中,非金属占了22种.在周期表中,除氢以外,其它非金属元素都排在表的右侧和上侧,属于p区.包括氢、硼、碳、氮、氧、氟、硅、磷、硫、氯、砷、硒、溴、碲、碘、砹、氦、氖、氩、氪、氙、氡。
非金属分类
非金属从状态上,在常温下可以分为固液气三种状态,例如:气态:氧气、氯气、氢气等;液态:溴等;固态:碘单质、石墨碳、硫磺等。
百度百科-非金属单质
百度百科-非金属
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












