置换反应的反应物中一定有金属单质_置换反应一定有金属参与反应或有金属生成
1.置换反应中不含金属单质的例子(化学式)(初中范围)
2.下列关于置换反应:X+Y=W+Z(反应条件已经略去)的描述正确的是( ) A.若X是金属单质,则W和Z中
3.置换反应的定义、特点、通式
4.置换反应对反应物有什么要求?
5.化学中取代反应与置换反应有什么区别
6.置换反应与还原反应的区别
取代反应一般在有机化学中才说。置换反应在有机化学和无机化学中都有。比如说金属钠与乙醇反应既是置换反应又是取代反应。一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,叫做置换反应。置换反应是化学反应的四大基本反应类型之一。
概念上的区别
取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应。 2.比较
取代反应:
(1)可与化合物发生反应,产物中不一定有单质。
(2)反应能否进行受催化剂、温度、光照等外界条件影响较大。
(3)逐步取代:很多反应是可逆的。由于共用电子对破裂而交换原子或原子团。
置换反应:
(1)反应物、产物中一定有单质。
(2)在水溶液中进行的置换反应应遵循金属或非金属活动性的顺序。
(3)反应一般单向进行。单质与化合物通过电子的转移而发生氧化还原反应
置换反应中不含金属单质的例子(化学式)(初中范围)
.概念上的区别
取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应。
2.比较
取代反应:
(1)可与化合物发生反应,产物中不一定有单质。
(2)反应能否进行受催化剂、温度、光照等外界条件影响较大。
(3)逐步取代:很多反应是可逆的。由于共用电子对破裂而交换原子或原子团。
置换反应:
(1)反应物、产物中一定有单质。
(2)在水溶液中进行的置换反应应遵循金属或非金属活动性的顺序。
(3)反应一般单向进行。单质与化合物通过电子的转移而发生氧化还原反应
下列关于置换反应:X+Y=W+Z(反应条件已经略去)的描述正确的是( ) A.若X是金属单质,则W和Z中
C+H2O=CO+H2 碳与高温水蒸汽反应。
CAO+H2O=CA(OH)2 SO2+H2O=H2SO4
酸性氧化物或碱性氧化物与水反应生成酸和碱
2H2O=2H2+O2 水的电解生成氢气和氧气。
2NA+2H2O=2NAOH+H2 活泼金属与水反应。
置换反应的定义、特点、通式
| A、若X是金属单质,则W和Z中有一种物质可以是金属单质,也可以是非金属单质,如Al和盐酸的反应,Al和氧化铁 的反应,故A错误; B、若X是非金属单质,则W和Z中有一种物质可以是非金属单质.如碳和水蒸气的反应,也可以是金属单质,如氢气还原氧化铜,故B错误; C、若X是含有金属元素的化合物,则W和Z中一定有金属单质,一种可以是含有金属元素的化合物.如铁和氯化铜反应;也可以是非金属化合物,如氢气还原氧化铜,故C错误; D、若X是不含有金属元素的化合物,生成的单质一定是来源于化合物,所以W和Z中一定有一种物质是非金属单质,故D正确; 故选D. |
置换反应对反应物有什么要求?
一、定义
置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应。
二、通式
置换反应可表示为A+BC=B+AC 或 AB+C=AC+B。
三、特点
置换反应的特点是反应物和生成物中都有单质。如CuO?+?CO?=Cu?+?CO?,尽管生成物中一种是单质另一种是化合物,但由于反应物中的两种物质都是化合物,不符合定义,因此该反应不属于置换反应。
扩展资料:
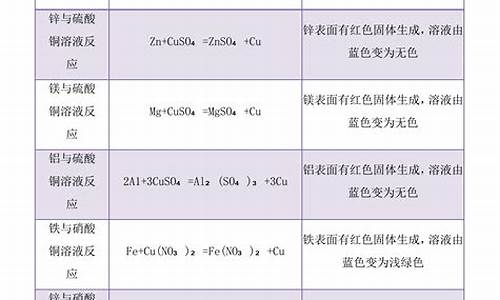
常见置换反应:
1、焦炭还原氧化铁3C+2Fe?O?==高温==4Fe+3CO?↑
现象:红色粉末变成黑色,澄清石灰水变浑浊。
2、木炭还原氧化铜C+2CuO==△==2Cu+CO?↑
现象:黑色粉末变成红色,产生的气体可以使澄清石灰水变浑浊。
3、氢气还原氧化铜H?+CuO==高温==Cu+H?O
现象:黑色粉末变成红色,试管内壁有水珠生成
4、氢气与氧化铁反应3H?+Fe?O?==高温==2Fe+3H?O
5、水蒸气通过灼热碳层C+H?O(g)==高温==CO+H?
百度百科-置换反应
化学中取代反应与置换反应有什么区别
1.一种金属可以置换出没有它活泼的金属(在非金属单质中也可使用这一原则) 2.在氢元素之前的金属元素,其物质可与酸发生置换反应,之后的不可反应(另:在金属活泼性前3的金属可直接与水反应) 化学元素的活泼性,是指元素与其他物质反应的难易程度。越易和别的物质反应,元素越活泼。越难与其他物质反应,元素越不活泼,即越稳定。 如果认为,氮气不如氧气活泼,这是单质(或者说是分子)的活泼性,而不是元素的活泼性。化学中要注意区分这些概念。因为,元素活泼性和分子活泼性的成因是完全不同的。 对于氮气和氧气,氮气的活泼型低于氧气的活泼性,本质是每个氮气分子中有三个氮氮键,加起来键能很高,所以氮分子中的氮原子结合得很牢固,其间的化学键不易断裂,导致不易发生原子重组(化学反应是原子重新组合的过程),所以不易反应,活泼性低。而氧分子中只有两个氧氧键,加起来键能比较低,所以易反应。当然,这也与氧元素的易得电子的性质有关联。但是,分子的活泼性,主要是看键能大小。(到了大学,也可以用分子轨道理论来解释,通过比较键级,从而比较分子的稳定性) 对于元素的活泼性,我们就主要考虑元素原子的最外层电子的排布情况。在这里,我也曾有过误区,现在明白了。原子最外层电子数不超过八(除第一周期外),最外层电子少于四(尤其是只有一个或两个电子时),易失电子,活泼;最外层电子大于四(尤其是有六个或七个电子),易得电子,同样活泼;而最外层电子为四或接近四时,不易得失电子,不活泼;最外层电子为八(第一周期,最外层电子为2)的元素(即稀有气体:氦氖氩氪氙氡),最稳定,组成惰性气体一族,因为不易一下失掉八个电子,也不易再得电子(因为得的电子填充到下一层,整体能量将增高,而物质要稳定是趋向于能量最低的状态,即能量最低原理)。 不要迷信金属活动性顺序表,那只是对于金属元素,而且过渡元素的不同价态还没能够考虑进去。
置换反应与还原反应的区别
取代反应:
是指有机化合物受到某类试剂的进攻,致使分子中一个基(或原子)被这个试剂所取代的反应。
置换反应:
是单质与化合物反应生成另外的单质和化合物的化学反应,是化学中四大基本反应类型之一。任何置换反应都不属于复分解反应,包括金属与金属盐的反应,金属与酸的反应等。
两者区别:
置换反应一般应在无机反应中,而取代反应一般说有机化学反应;
取代反应不一定有单质参加或生成;而置换反应中一定有单质参加或生成;
代反应能否进行,一般受温度、光照、催化剂等影响较大;
取代反应逐步进行,一般都为可逆的。
1,发生反应的物质不同:置换反应有单质和化合物参加,并生成单质和化合物。还原反应一般伴随化学价升降,一般不要求一定有单质参加。
2,包含不同:置换反应必须是一种单质和一种化合物反应生成另一种单质和另一种化合物,是一种氧化还原反应。还原反应可以不是置换反应。
扩展资料:
放热反应:
1,金属和酸发生的置换反应。
2,金属和盐发生的置换反应。
3,铝和金属氧化物发生的置换反应。
4,活泼金属和水的置换反应。
吸热反应:
1,不太活泼的金属和水蒸气发生的置换反应。
2,碳,氢气还原金属氧化物的反应。
3,碳和水蒸气的置换反应。
参考资料:
百度百科——置换反应参考资料:
百度百科——还原反应声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












