探究金属的某些物质性质和化学性质_某同学探究金属单质
1.某同学从《化学教育》杂志中得知:冶金工业可用金属单质与某种金属氧化物反应的原理来制备另一种金属单质
2.某同学设计实验以探究元素性质的递变规律,实验装置如图所示。 实验Ⅰ:根据元素最高价含氧酸的酸性强弱
3.在实验室中,小明同学为了探究金属与盐溶液的反应规律,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3
4.某同学做元素金属性和非金属性递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,
5.某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素.选用的试剂如下:镁条、铝条、铝粉
6.某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现
7.X、Y、Z是三种不同的金属,为比较金属活动性的强弱,某同学利用这三种金属单质、盐酸、含Z的化合物溶液进
根据表格不难看出,只有金属Y、W和盐酸反应,说明只有这两种金属排在氢前,而且Y可以和W的硝酸盐溶液反应,说明Y在W前;X可以和Z的硝酸盐溶液反应,说明X在Z的前面,故这四种金属的活动性Y>W>X>Z,故选A.
某同学从《化学教育》杂志中得知:冶金工业可用金属单质与某种金属氧化物反应的原理来制备另一种金属单质
| 实验准备(2)CO 2 +Ca(OH) 2 = CaCO 3 ↓+H 2 O 实验结论 铜?一氧化碳溶液变浑浊(或出现白色沉淀) 反思评价(1)水蒸气冷凝而倒流,造成热的试管炸裂 (2)不能?二氧化碳不能燃烧,使混合气体不能点燃 |
| 试题分析:(2)二氧化碳能使澄清的石灰水变浑浊。可利用二氧化碳的这一性质检验其存在。反应的化学方程式为:CO 2 +Ca(OH) 2 = CaCO 3 ↓+H 2 O 实验与结论A中固体由黑色变成红色,说明有黑色的氧化铜与木炭反应生成了红色的铜 B中**试纸没有变蓝说明没有一氧化碳生成 反应中有CO 2 生成由会使C中的澄清石灰水变浑浊 反思与评价 (1) 如果A装置中的试管口高于试管底部,在实验过程中可能会因水的倒流而造成试管的炸裂。 (2)设产生的气体是CO和CO 2 的混合气体,则不能直接用点燃的方法来检验CO 2 。因为二氧化碳不能燃烧,使混合气体不能点燃。 |
某同学设计实验以探究元素性质的递变规律,实验装置如图所示。 实验Ⅰ:根据元素最高价含氧酸的酸性强弱
| (1)固体全部溶解,有气体放出,水溶液呈浅绿色。 (2)3Zn+Fe 2 O 3 3ZnO+2Fe;Fe+2HCl===FeCl 2 + H 2 ↑;(或ZnO+2HCl===ZnCl 2 +H 2 O) (3)金属活动性强弱程度不同,反应的剧烈程度不同。 (4)一种金属能在高温下夺取另一种比它弱的金属氧化物中的氧,能够将另一种金属冶炼出来。 |
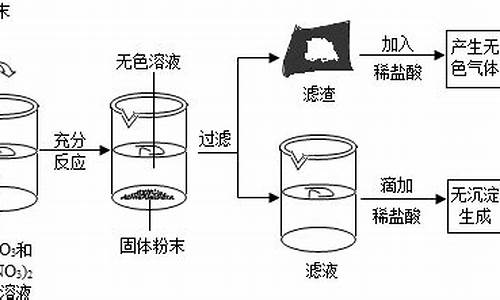
在实验室中,小明同学为了探究金属与盐溶液的反应规律,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3
(1)CaCO
3
+2H
+
=Ca
2
+
+CO
2
↑+H
2
O 溶液变浑浊
(2)除去二氧化碳中混有的硝酸蒸气
(3)HNO
3
>H
2
CO
3
>H
2
SiO
3
N>C>Si
(4)Cl
2
+2Br
-
=Br
2
+2Cl
-
(5)吸收尾气,防止氯气污染环境
(6)Cl
2
>Br
2
Cl>Br
(1)A中硝酸与碳酸钙反应产生二氧化碳:CaCO
3
+2HNO
3
=Ca(NO
3
)
2
+CO
2
↑+H
2
O,碳酸的酸性比硅酸强,发生反应:Na
2
SiO
3
+CO
2
+H
2
O=H
2
SiO
3
↓+Na
2
CO
3
或Na
2
SiO
3
+2CO
2
+2H
2
O=2NaHCO
3
+H
2
SiO
3
↓,因此C中产生白色沉淀或溶液变浑浊。
(2)由于硝酸具有挥发性,为避免硝酸与硅酸钠反应而干扰二氧化碳与硅酸钠溶液反应,必须净化二氧化碳,利用饱和碳酸氢钠溶液吸收硝酸蒸气。
(3)由实验现象可知三种酸中,硝酸酸性最强,硅酸酸性最弱;由此推知,氮的非金属性最强,硅的非金属性最弱。在元素周期表中,氮和碳位于同一周期,碳与硅位于同一主族,由此可以推出同主族、同周期非金属元素性质的递变规律。
(4)题目已限制探究氯与溴的非金属性强弱,所以B中应装溴化钾或溴化钠溶液。
(5)由于尾气中含有氯气,故要用碱溶液吸收,以避免污染环境。
(6)根据置换反应可得出单质的氧化性强弱。
某同学做元素金属性和非金属性递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,
由题意可知,溶液显蓝色,说明了溶液中存在着铜离子;由滤渣中加入稀盐酸无气体产生,说明在滤渣不存在着活泼金属;由向溶液中滴加稀盐酸无沉淀生成,可以判断滤液的银离子已被完全置换出来.由此可知:
A、由于向溶液中滴加稀盐酸无沉淀生成,说明了滤液中一定没有银离子.故A正确;
B、若加入的金属M是铜,则滤渣中只含有银.故B正确;
C、若加入的金属M是铜,恰好与硝酸银反应,则滤渣中一定不含有单质铜.故C错误;
D、由于锌的活泼性大于铜和银,生成的硝酸锌是无色,所以,加入的金属M可能是单质锌.故D正确.
故选C.
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素.选用的试剂如下:镁条、铝条、铝粉
(1)①镁与热水反应,生成氢气和氢氧化镁,反应后溶液呈碱性,故现象为有气体产生,溶液变成浅红色;
②钠的密度比水小,与水剧烈反应生成氢气和氢氧化钠溶液,故现象为浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;
③Na2S具有还原性,氯气具有氧化性,二者发生氧化还原反应生成单质硫,故现象为生成淡**沉淀;
④铝能与盐酸反应,较镁不活泼,故现象为反应不十分剧烈;产生无色气体;
⑤镁为活泼金属,与盐酸发生置换反应,故现象为剧烈反应,迅速产生大量无色气体;
⑥A1Cl3与NaOH反应生成A1(OH)3,A1(OH)3具有,能与NaOH反应生成可溶于水的偏铝酸钠,故现象为生成白色胶状沉淀,继而沉淀消失.
则
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | C | F | A | D | B | E |
故答案为:
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | C | F | A | D | B | E |
(2)①Na与冷水反应剧烈,Mg与热水反应,与酸剧烈反应,而铝与酸缓慢反应,金属与水或酸反应越剧烈,金属越活泼,金属性越强;
故答案为:Na>Mg>Al;
②向新制得的Na2S溶液中滴加新制的氯水,生成淡**沉淀,说明氯气可置换出硫,则氯气的氧化性大于硫,说明氯元素的非金属大于硫,
故答案为:Cl>S;
③由①②可知同一周期,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强;
故答案为:金属性;非金属性.
某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现
| (1)钠块浮在水面上,说明钠的密度比水小,熔化成闪亮的小球,说明该反应放热,并且钠的熔点较低, 故答案为:熔化成闪亮的小球; (2)在相同条件下反应,物质的自身性质不同,反应速率不同,由于镁较铝活泼,则镁与盐酸反应较剧烈,故答案为:反应物的性质; (3)同周期元素从左到右非金属性逐渐增强,则Cl的非金属性较S强,单质的氧化性较强,可发生:Cl 2 +S 2- =2Cl - +S↓, 故答案为:Cl 2 +S 2- =2Cl - +S↓;强于; (4)由于铝粉的表面积较大,盐酸的浓度较大,易与盐酸发生反应,则影响化学反应速率的因素与浓度和表面积有关,故答案为:否;增大反应物的浓度;增大固体反应物的表面积. |
X、Y、Z是三种不同的金属,为比较金属活动性的强弱,某同学利用这三种金属单质、盐酸、含Z的化合物溶液进
| (1)金属铝的表面有一层致密的氧化物薄膜,氯化铝和硫酸铝阴离子的不同,氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能, 故答案为:C;在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(注意:不能加入盐酸),若反应明显加快了,说明上述推断正确; (2)金属铜呈暗红色,金属铝能置换铜盐中的金属铜,即2Al+3Cu 2+ =3Cu+2Al 3+ ;氯化铜和硫酸铜均是强酸弱碱盐,水解显酸性,金属铝能和酸反应产生氢气,故答案为:Al 3+ +3H 2 O
Al(OH) 3 +3H + ,Cu 2+ +2H 2 O
Cu(OH) 2 +2H + ,2Al+6H + =2Al 3+ +3H 2 ↑, (3)金属铝能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快,开始阶段产生气体的速率不断加快的原因是其中某一个或多个因素的结果, 故答案为:氢气;随着反应进行生成铝离子浓度增大(或水解程度增大,产生大量H + 或该反应放热,升高温度反应加快或铜与铝构成原电池,加快铝失电子); (4)A、用砂纸擦去铝片表面的氧化膜,再投入硫酸铜溶液中,形成铝铜原电池,能加速金属的腐蚀,故A正确; B、氧化铝能和强碱反应,然后把铝片投入投入硫酸铜溶液中,形成铝铜原电池,能加速金属的腐蚀,故B正确; C、硫酸铜和氢氧化钠发生复分解反应生成氢氧化铜沉淀和硫酸钠,再投入铝片不反应,故C错误; D、在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中,会形成铜、铝、硫酸铜原电池,金属铝做负极,加快反应速率,故D正确. 故答案为:ABD; (5)铝片与铜片为电极,电解质溶液为盐酸时,金属铝做负极,当氢氧化钠作电解质时,仍是金属铝做负极,当电解质是浓硝酸时,金属铝和它钝化,所以铜做负极了,得看自发的氧化还原反应中失电子的单质原子是谁,故答案为:B;电解质的性质. |
首先根据X、Y、Z是三种不同的金属,其中Y可以和盐酸反应,说明Y金属活动性位于氢前,活动性强于X和Z;然后根据X能置换出Z的化合物中的Z,说明,X的金属活动性强于Z;故Y>H>X>Z.
故选C.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












