金属单质与酸反应生成盐_金属单质与酸反应
1.金属和酸反应的方程式
2.性强弱为什么要单质与酸与水反应来判
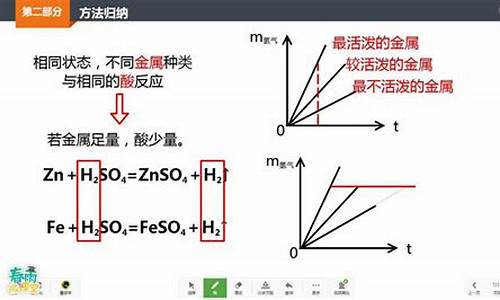
(1)酸 + 金属单质 -------- 盐 + 氢气 (置换反应)
Zn + H2SO4 = Zn SO4 + H2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制氢气
Fe + H2SO4 = Fe SO4 + H2↑ 有气泡产生、铁钉逐渐溶解,溶液呈浅绿色
(2) 酸+碱性氧化物 -------- 盐 + 水
Fe2O3 + 6HCl= 2FeCl3 + 3 H2O 铁锈消失,溶液逐渐变成**
Fe2O3 + 3 H2 SO4 = Fe2(SO4)3 + 3 H2O 铁锈消失,溶液逐渐变成黄
(3)酸 + 碱 -------- 盐 + 水 (中和反应)
盐酸和烧碱起反应:HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2 H2O蓝色沉淀消失,溶液变蓝色
(4)酸 + 盐 -------- 另一种酸 + 另一种盐
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 大理石的表面有气泡产生
HCl + AgNO3 = AgCl↓ + HNO3 有不溶于硝酸的白色沉淀生成
(5)酸与酸碱指示剂反应,使紫色石蕊试剂变红,无色酚酞不变色
金属和酸反应的方程式
金属与酸反应的图像如下:
金属与酸反应是一种常见的化学反应,在这个过程中,金属与酸发生相互作用,生成相应的金属盐和氢气。
这类反应符合activity序列,即金属的活动性越高,与酸反应的速率越快。金属与酸反应的化学方程式一般形式为:金属(M)+酸(HX)→金属盐(MX)+氢气(H2);其中,M代表金属,HX代表酸,MX代表生成的金属盐。
反应过程中,金属原子失去电子,形成正离子(M+),酸中的氢离子(H+)则接受这些电子,生成氢气。同时,金属离子与酸中的阴离子(X-)结合,形成金属盐。金属与酸反应的速度受到许多因素的影响,如金属的活动性、酸的浓度、反应温度等。
活动性较高的金属(如钠、钾等)与酸反应时,反应速度迅速;而活动性较低的金属(如铜、铁等)与酸反应时,反应速度较慢。需要注意的是,并非所有金属都与酸反应。一些不活泼的金属(如金、银等)与酸之间不会发生反应。
此外,在反应过程中,还需注意酸的腐蚀性和安全性,避免对人体和环境造成伤害。
金属
一般指具备特有光泽(即对可见光强烈反射)而不透明、具有延展性及导热导电性的一类物质。狭义的金属概念为由金属元素组成的单质。纯金属在常温下一般都是固体(汞除外),大多数为电和热的优良导体,密度较大,熔点较高。
地球上的金属广泛地存在于地壳和海洋中,除少数很不活泼的金属如金、银等有单质形式存在外,其余都以化合物的形式存在。金属在自然界中广泛存在,在生活中应用极为普遍,在现代工业中是非常重要和应用最多的一类物质。
酸反应
酸性反应一般指水溶性中产生的质子(H+)或水合质子(H3O+)与其它物质作用使溶液的氢离子浓度增加或pH值降低的化学反应。
例如酸雨形成过程中,酸性物质(如SO2、NO2等)在雨水中所发生的化学反应。亦可视作产生与溶剂相同的阳离子的化学反应。如NH4CN(NH4CN=NH4++CN-)溶于液态NH3(2NH3=NH4++NH2-)中,使NH4+增加,即酸性增加的反应。
性强弱为什么要单质与酸与水反应来判
金属和酸反应的方程式介绍如下:
金属和酸反应的化学方程式:2Na+2H2O=2NaOH+H2↑。
酸在化学上是指在水溶液中电离时产生的阳离子都是氢离子的化合物,可分为无机酸、有机酸。酸碱质子理论认为:能释放出质子的物质总称为酸。路易斯酸碱理论认为亲电试剂或电子受体都是路易斯酸。
金属与酸反应化学方程式:
1、金属单质+盐(溶液)---另一种金属+另一种盐
铁与硫酸铜反应:Fe+CuSO4==Cu+FeSO4。
现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
(古代湿法制铜及“曾青得铁则化铜”指的是此反应)。
锌片放入硫酸铜溶液中:CuSO4+Zn==ZnSO4+Cu。
现象:锌片表面覆盖一层红色的物质,溶液由蓝色变成无色。
铜片放入硝酸银溶液中:2AgNO3+Cu==Cu(NO3)2+2Ag。
现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色。
2、金属氧化物+木炭或氢气→金属+二氧化碳或水
焦炭还原氧化铁:3C+2Fe2O3==高温4Fe+3CO2↑。
木炭还原氧化铜:C+2CuO==高温2Cu+CO2↑。
现象:黑色粉未变成红色,澄清石灰水变浑浊。
首先一点,元素的金属性是指元素的原子失电子的能力.
金属性越强,则越容易失去电子.金属性的强弱就是失去电子能力的难易程度.把这点概念先搞清楚.
金属单质与酸反应的本质是:一个金属R,与酸释放出来的H+反应,R失去电子,H+得到电子.
OK,现在得电子的物质是相同的,都是H+,那只需比较金属R失电子的难以程度即可比较金属性的强弱.
在酸溶液中,H+的浓度比较大,通过金属反应时放氢气的速率来比较.
但是有的金属性非常强的金属,就很难通过和酸反应来比较了.凭眼睛的观察是感觉不出来放氢气的差异的.所以就要通过跟水的反应来比较.水会微弱电离,产生极少量的H+,你可以把水视为一种弱酸.一个金属能跟水反应,一个不能跟水反应,两者失电子能力一目了然.
跟水反应时的剧烈程度也能比较出金属性强弱,越剧烈者,越易失电子,则金属性越强.反之亦然.
跟水反应的条件也可以比较,钠与水直接反应,镁与水反应需加热.条件越简单,金属性越强,条件越苛刻,则电子越难失去,金属性亦弱.
其实金属性的强弱比较,类似于比较非金属性的强弱,相互印证对比,相信对你理解这样的问题有更大的帮助.想想卤素跟氢气反应的难以程度.通过反应条件来比较元素的性质是常用的方法.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












