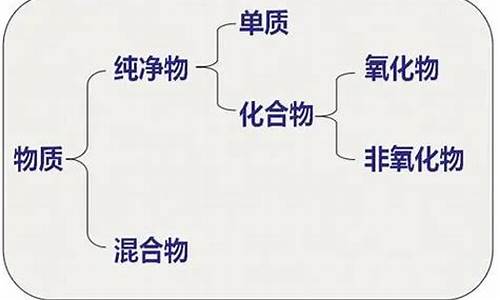
金属单质在反应中只能做还原剂_金属单质在反应中
1.金属单质能与什么物质发生反应反应(详细点,例子)
2.反应物中已经有铁单质了,为什么还要标沉淀符号
3.(1)锂是一种金属单质,化学式为Li,锂原子结构示意图为,在反应中易______ (填“失去”或“得到”)
4.金属单质与非金属单质反应
5.金属单质与盐反应
6.金属单质和盐反应
金属单质与酸反应会产生相应的金属盐和氢气的反应。
1.反应原理
当金属单质与酸发生反应时,金属原子会失去电子成为正离子,同时酸分子会失去质子成为负离子。正离子和负离子结合形成金属盐,同时释放出氢气。这是一种氧化还原反应,金属被氧化成金属离子,而酸被还原成负离子。
2.反应类型
金属单质与酸的反应属于酸碱中的酸与金属反应,也可以看作是氧化还原反应。金属单质的反应能力与其活动性有关,活泼的金属在酸中反应较为剧烈,而不活泼的金属则反应较为缓慢。
3.金属盐的生成
金属单质与酸反应后,会生成相应的金属盐。金属盐是由金属离子和酸中的阴离子结合而成的。不同金属与不同酸反应时产生的金属盐也不同,例如铁与盐酸反应产生氯化铁,锌与硫酸反应产生硫酸锌等。
4.反应速率
金属单质与酸反应的速率取决于多个因素,包括金属的活性、酸的浓度和温度等。活泼的金属(如钠、钾)与酸反应迅速,产生大量氢气,并伴有剧烈的反应。而不活泼的金属(如铜、银)与酸反应较慢,需要较长的时间才能完全反应。同时,较高浓度的酸和较高温度也会加快反应速率。
5.实验观察
实验中可以观察到金属单质与酸反应的现象。例如,当将锌片放入盛有稀盐酸的试管中,可以看到锌片表面产生气泡,并且试管内的液体逐渐变浑浊。这是因为锌与盐酸反应生成氯化锌和氢气的结果。反应结束后,可以通过测试气体的性质确认气体为氢气。
6.应用领域
金属单质与酸反应在生活中和工业上有广泛的应用。例如,将金属与酸反应可以用于清除金属表面的氧化层,以便进行后续的处理和使用。此外,金属与酸的反应也可以用于制备金属盐和氢气。这些金属盐在化学工业中有着广泛的应用,如用于催化剂、电镀和药物制剂等。
金属单质能与什么物质发生反应反应(详细点,例子)
A、因元素的化合价处于最高价时在反应中只能降低不能升高,在反应中得到电子,则化合物中某元素处于最高价只能被还原,故A正确;
B、金属单质在氧化还原反应中只能作还原剂,但非金属单质既可作氧化剂也可作还原剂,如氯气和水的反应中氯气既作氧化剂又作还原剂,故B错误;
C、失电子越多的还原剂,其还原性不一定强,还原性强与失去电子的难易程度有关,如Na与Al比较,Na的还原性强,故C错误;
D、某元素在反应中由化合物转化为单质,该元素可能被氧化也可能被还原,如2H2S+SO2═3S↓+2H2O,故D错误;
故选A.
反应物中已经有铁单质了,为什么还要标沉淀符号
金属我们学的主要有:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au。前三种都可以和水,酸反应,而Mg可以与热水反应,与冷水不反应,在H前面的金属都可以和酸反应,Al是一种特别的金属,具有也就是说,它既能和酸也能和碱反应。H后面的既不能和酸也不能和碱反应。
(1)锂是一种金属单质,化学式为Li,锂原子结构示意图为,在反应中易______ (填“失去”或“得到”)
反应物中已经有铁单质了,为什么还要标沉淀符号
氢氧化亚铁和氧气和水反应生成氢氧化铁不需要加沉淀符号。
因为反应前的氢氧化亚铁是沉淀,所以后面的氢氧化铁不需要加沉淀符号。
化学方程式是:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
沉淀符号使用原则:
1、 在溶液中进行的化学反应,有难溶物质或不溶物质生成时,用“↓”号表示。
2、若反应不是在溶液中进行的,就不存在沉淀析出现象,不能用“↓”号。
3、对于金属与盐溶液之间的置换反应,生成的金属单质,由于覆盖在金属的表面,没有沉淀析出,不应使用“↓”号。
4、在复分解反应中,若生成物是微溶物时,应把它视为“沉淀”,标上“↓”。
5、如果反应物中已经有沉淀,反应生成物中的沉淀不标“↓”。
金属单质与非金属单质反应
(1)由锂原子结构示意图可知,最外层电子数是1,少于4个,在反应中易失去1个电子.,锂元素化合价为+1价,氧元素的化合价为-2价,形成的氧化物的化学式是:Li2O.
(2)由题意可知,在化学反应A→B+C,D在反应中作催化剂,12gA与3gD混合后使反应完全生成了8gB,根据质量守恒定律可知,生成的C的质量为:12g-8g=4g.
(3)甲醇在氧气中完全燃烧的产物是CO2和H2O,由于生成物种含有碳、氢、氧三种元素,由质量守恒定律反应前后元素的种类不变可知.则甲醇肯定含有碳、氢元素,可能含有氧元素.
故答为:(1)失去;Li2O.(2)4;(3)碳、氢.
金属单质与盐反应
金属单质与非金属单质之间的反应金属会失去电子,形成阳离子,而非金属会接受电子,形成阴离子。
反应说明:
当金属与非金属发生反应时,通常会产生离子化合物。以钠和氯气的反应为例,钠是一种金属单质,氯是一种非金属单质。钠原子会失去一个电子,形成钠离子(Na+),而氯原子会接受一个电子,形成氯离子(Cl-)。
这两种离子会结合在一起形成氯化钠(NaCl),这是一种常见的离子化合物,也就是我们日常生活中使用的食盐。
共价键的形成:
除了离子化合物的形成,金属单质与非金属单质之间还可以发生共价键的形成。共价键是一种化学键,通过电子的共享来形成。
氧气和氢气的反应就是通过共价键的形成来实现的。氧气是一种非金属单质,氢气也是一种非金属单质。当氧气和氢气反应时,氧原子和氢原子会共享电子,形成水分子(H2O)。在水分子中,氧原子与氢原子通过共价键连接在一起。
金属单质与非金属单质之间的反应的意义:
1.形成新的化合物
金属单质与非金属单质之间的反应通常会形成新的化合物,这些化合物具有不同的性质和用途。这为人们开发新材料和应用提供了广阔的空间。
2.提供新的能源
某些金属单质与非金属单质之间的反应可以释放出大量的能量,如金属与非金属的燃烧反应。这些反应可以用来作为能源,如金属燃料电池的应用。
3.促进科学研究和技术进步
金属单质与非金属单质之间的反应是化学研究和技术发展的重要基础。通过研究这些反应,人们可以深入了解元素之间的相互作用和反应机制,进一步推动科学的发展。
4.扩展应用领域
金属单质与非金属单质之间的反应可以开发出各种具有特殊性质和功能的材料,如合金、陶瓷等。这些材料广泛应用于建筑、电子、航空航天等领域,推动了社会的进步和发展。
5.提供化学反应的多样性
金属单质与非金属单质之间的反应具有多样性,可以发生不同类型的反应,如离子化合物的形成、共价键的形成等。这种多样性丰富了化学反应的研究内容,拓宽了化学反应的应用领域。
金属单质和盐反应
金属单质与盐反应是一种常见的化学反应类型,这种反应通常涉及到了氧化还原反应。
扩展知识:
金属单质与盐反应需要一定的条件才能发生。首先,必须满足金属单质的活性要大于与它发生反应的金属离子的活性。其次,需要确保金属单质在溶液中不会发生氧化或水解等副反应。此外,温度和压力也会影响这种反应的进行。
金属单质与盐反应的原理主要是置换反应。在这种反应中,金属单质(通常是较活泼的金属)可以与另一种金属化合物(通常是盐)反应,生成另一种金属单质和另一种盐。这种反应的本质是金属原子与金属离子之间的电子交换。
金属单质与盐反应在工业上和实验室中都有广泛的应用。例如,可以利用这种反应制备某些不易获得的金属单质,也可以利用这种反应进行某些元素的分离和提纯。在实验室中,可以通过观察这种反应来研究金属的化学性质和化学反应动力学。
以铁和硫酸铜的反应为例,铁是一种比较活泼的金属,硫酸铜是一种盐,当它们混合在一起时,会发生置换反应,生成铜和硫酸亚铁。具体反应方程式为Fe+CuSO4=Cu+FeSO4。在这个过程中,铁原子从硫酸铜分子中夺取了铜原子,自身被氧化成了二价铁离子,而铜离子则被还原成了铜原子。
金属单质与盐反应需要注意一些问题。首先,要确保使用的金属单质和盐都是纯净的,以避免杂质对反应的影响。其次,要控制好反应条件,例如温度、压力、溶液的pH值等,这些因素都会影响反应的速率和产物的性质。此外,还需要注意操作安全,避免金属单质和盐对环境和人体的危害。
综上所述,金属单质与盐反应是化学中常见的反应之一,这种反应涉及到置换反应和氧化还原反应两个基本概念。在实践中,需要掌握好反应原理、条件及应用范围,同时注意实验安全,确保得到良好的实验结果。
金属单质和盐之间可以发生不同的反应。以下是一些典型的金属单质和盐反应的示例:
1、金属单质和盐的置换反应:金属单质可以取代盐中的金属离子,形成新的盐和游离的金属。
例如,锌和盐酸反应会生成氯化锌和氢气的挥发。Zn(s)+2HCl(aq)→ZnCl2(aq)+H2(g)
2、金属单质和盐的氧化还原反应:某些金属单质可以氧化盐中的金属离子,同时自身被还原。这类反应包括金属的腐蚀或金属离子的还原。
例如,铁可以还原铜离子,生成铁离子和铜单质。Fe(s)+CuSO4(aq)→FeSO4(aq)+Cu(s)
3、其他反应:金属单质和盐还可以通过复合反应或双替换反应发生其他类型的化学变化。这些反应的结果可能根据反应条件和参与的物质而有所不同。
需要注意的是,不是所有金属单质和盐都会发生反应。反应的发生与金属的电位、盐中金属离子的活性以及反应条件等因素有关。在具体实验或化学反应中,应根据具体情况进行考虑和实施。
当金属单质和盐发生反应时,可能会观察到以下现象:
1、气体释放:在某些反应中,金属单质与盐溶液反应会产生气体。例如,金属与酸类盐反应会释放出氢气。
2、溶液变色:反应可能导致溶液的颜色发生变化,这可能是由于盐中的金属离子被金属单质取代或还原导致的。
3、沉淀生成:在一些反应中,会形成可见的沉淀物,这是由于反应生成的新盐的溶解度较低而导致的。
4、金属溶解:在一些情况下,金属单质可以溶解于盐溶液中形成金属离子,并且观察不到明显的反应产物。
需要注意的是,金属单质和盐反应的具体现象可能取决于所选用的金属和盐的类型,反应条件(如浓度、温度等)以及反应过程中的其他因素。因此,在具体实验或化学反应中,应根据具体情况进行观察和分析。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。